Superlaser enthüllen die Struktur von Schlüsselproteinen
Strukturbiologen aus Hamburg, Lübeck und Tübingen gehen neue Wege in der Erforschung von Proteinen in Krankheitserregern
Wissenschaftler der Universitäten Hamburg, Lübeck und Tübingen haben in Zusammenarbeit mit dem Deutschen Elektronen-Synchrotron DESY und weiteren Forschergruppen ein neues Experiment erfolgreich durchgeführt, das sie in der aktuellen Online-Ausgabe der Fachzeitschrift „Nature Methods“ beschreiben: Sie züchteten erstmals Nanokristalle von Proteinen in ihrer natürlichen Form in lebenden Zellen und erhielten durch Bestrahlung mit einem Freien-Elektronen-Laser Daten zur räumlichen Struktur der Proteine mit hoher Auflösung.
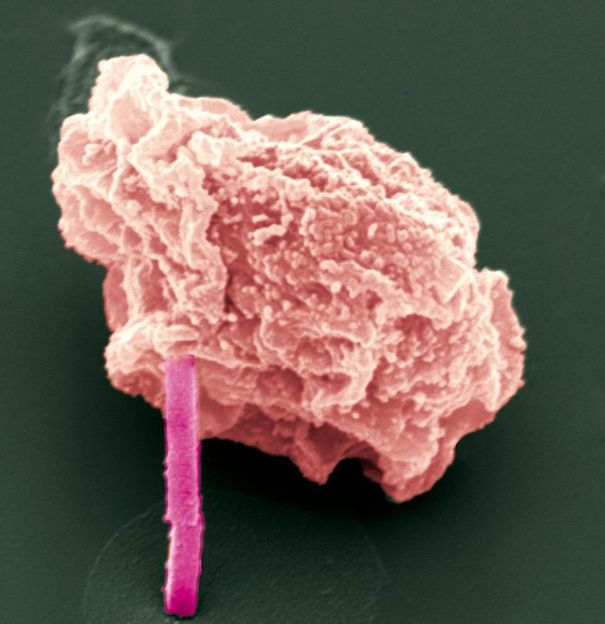
Elektronenmikroskopische Aufnahme einer Insektenzelle, aus der ein Proteinkristall (pink) herausragt.
Michael Duszenko/ Universität Tübingen
Die dreidimensionale Struktur der Proteine gibt Aufschluss darüber, welche Funktion sie bei der Steuerung einer Zelle in Organismen übernehmen. Wissen über die Struktur bietet somit beispielsweise die Grundlage für die Bekämpfung bakterieller Zellen oder Parasiten und unterstützt die Entwicklung neuer Wirkstoffe gegen Krankheitserreger.
Bisher war zur Aufklärung der dreidimensionalen Struktur von Proteinen durch Röntgenstrukturanalyse ein aufwendiges Verfahren nötig, denn Wissenschaftler mussten von ausgewählten Proteinen Kristalle mit einer Kantenlänge von mindestens 100 Mikrometer in jede Richtung züchten.
Mit einem „Freien-Elektronen-Laser“ in Stanford, Kalifornien, konnte die Forschergruppe nun hochintensive Röntgenpulse nutzen und viel kleinere Kristalle, nämlich Nanokristalle von nur wenigen Mikrometern Kantenlänge, untersuchen. Die Züchtung von Nanokristallen des Enzyms Cathepsin B aus dem Parasiten Trypanosoma brucei, dem Erreger der Schlafkrankheit, gelang den Strukturbiologen erstmalig in lebenden Insektenzellen.
Das Ergebnis zeigt, dass es mit der neuen Technologie möglich wird, Daten zur Proteinstruktur von Nanokristallen in hoher Qualität zu bekommen. Neben der vom Bundesministerium für Bildung und Forschung geförderten Nachwuchsgruppe „Strukturelle Infektionsbiologie unter Anwendung neuartiger Strahlungsquellen (SIAS)“ der Universitäten Hamburg und Lübeck und der Hamburg School for Structure and Dynamics in Infection (SDI) der Landesexzellenzinitiative Hamburg, waren ein Forscherteam um Prof. Michael Duszenko von der Universität Tübingen und Prof. Henry Chapman vom DESY beteiligt.
SIAS, initiiert von den Strukturforschern Prof. Christian Betzel, Universität Hamburg, und Prof. Rolf Hilgenfeld, Universität Lübeck, forscht seit 2010 zur Anwendung neuartiger Strahlungsquellen auf die Strukturbestimmung von Proteinen und anderen biologischen Molekülen. Ab 2015 wird ein solcher „Superlaser“ mit dem „Europäische X-FEL“ beim DESY in Betrieb gehen.
Prof. Michael Duszenko, Leiter der Abteilung Molekulare Parasitologie an der Universität Tübingen: „Bei der Klonierung von Cathepsin B, eines Enzyms aus Trypanosomen, konnten wir zeigen, dass sich in vivo Kristalle bilden. Aufgrund der geringen Größe und Fragilität dieser Kristalle wäre es allerdings unmöglich gewesen, diese zur Strukturanalyse zu nutzen. Deshalb hat der glückliche Umstand, dass gerade jetzt die neuartige Lasertechnologie in Kalifornien verfügbar war, dieses Projekt ideal ergänzt und neue Türen in der Strukturbiologie geöffnet. Ohne die fruchtbare Kooperation zwischen Tübingen, Hamburg und Lübeck wären die Ergebnisse nicht möglich gewesen.“
Dr. Lars Redecke, Leiter der Nachwuchsgruppe SIAS: „Unser Ergebnis zeigt, dass die Superlaser völlig neue Möglichkeiten in der Strukturaufklärung biologischer Makromoleküle bieten können. Vielleicht sind die Zeiten bald vorbei, in denen wir oft Monate oder Jahre brauchten, um von bestimmten Proteinen Kristalle zu züchten, die groß genug für Synchrotronstrahlungsquellen sind. Ich bin stolz, dass die Universitäten Hamburg, Lübeck und Tübingen bei diesen neuen Entwicklungen an vorderster Front dabei sind“.
























































