Flexible Regalsysteme sortieren Moleküle
Wichtig für die Herstellung von Medikamenten
Ein flexibles und effizientes neues Verfahren zur Trennung von Enantiomeren haben Forscher des Karlsruher Instituts für Technologie (KIT) und der Ruhr-Universität Bochum (RUB) entwickelt. Die Enantiomerentrennung ist unerlässlich für die Herstellung vieler Medikamente. Bei ihrem Verfahren setzen die Wissenschaftler poröse molekulare Gerüststrukturen (MOFs) ein, die sie nach einer eigens entwickelten Methode schichtweise auf Festkörpersubstraten aufbauen.
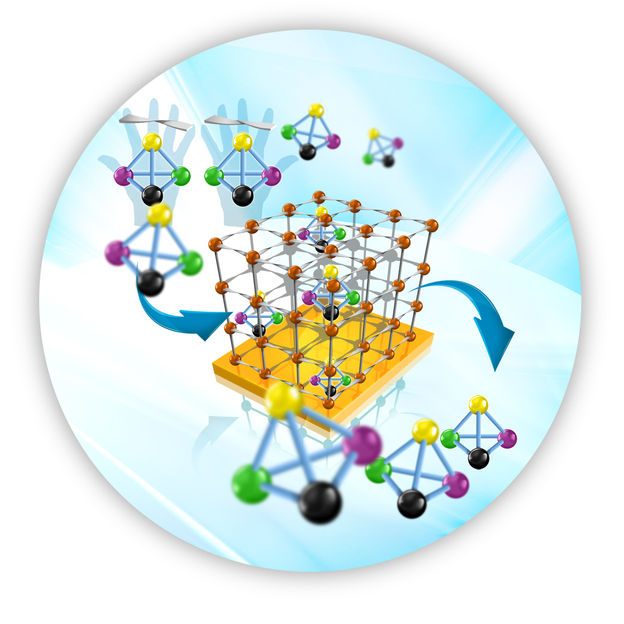
Ein molekulares Gerüst, das auf einer Oberfläche verankert ist, trennt die gewünschten Enantiomere ab.
© Grafik: KIT-IGF
Chiralität: linker und rechter Handschuh
Enantiomere sind paarweise auftretende, räumlich zueinander spiegelbildlich aufgebaute Moleküle. Sie unterscheiden sich voneinander wie ein linker und ein rechter Handschuh. Diese als Chiralität bezeichnete Eigenschaft von Molekülen spielt vor allem in den Biowissenschaften und der Pharmazie eine Rolle. „Während viele, besonders kleinere, Moleküle wie Kohlendioxid oder Methan nicht chiral sind, weisen zahlreiche biologisch relevante Moleküle, beispielsweise Weinsäure, diese Eigenschaft auf“, erklärt Professor Christof Wöll, Leiter des Instituts für Funktionelle Grenzflächen (IFG) des KIT. Für viele Medikamente ist nur eines der beiden Enantiomere erwünscht, damit die Wirkstoffmoleküle an bestimmte Strukturen im Körper andocken können.
Schnelles und kostengünstiges Verfahren
Gegenüber den bisher eingesetzten Methoden ermöglicht das von den Forschern um Professor Wöll, Professor Roland Fischer vom Lehrstuhl für Anorganische Chemie II der RUB und Humboldt-Stipendiat Bo Liu (KIT und RUB) entwickelte Verfahren eine schnellere und damit auch kostengünstigere Enantiomerentrennung. Es basiert auf neuartigen molekularen Gerüststrukturen (MOFs), die sich auf Festkörpersubstraten verankern lassen. Diese porösen Beschichtungen, auch als SURMOFs bezeichnet, entstehen durch ein von den Forschern eigens entwickeltes Epitaxieverfahren: Statt, wie sonst üblich, die aus den Ausgangsstoffen hergestellten Lösungsgemische zu erhitzen, werden modifizierte Substrate abwechselnd in die Lösungen der Ausgangsstoffe getaucht. „Auf diese Weise werden die molekularen Schichten etagenweise aufgebaut – vergleichbar mit einem Regalsystem“, erläutert Roland Fischer. Diese auf Oberflächen verankerten molekularen Regalsysteme lassen sich für verschiedene Anwendungen funktionalisieren.
Größere Maschen für pharmazeutische Wirkstoffe
Zur Enantiomerentrennung dienen chirale organische Moleküle als Verstrebungen der Regalsysteme. Dank ihrer homochiralen Struktur halten diese Beschichtungen jeweils eines der beiden Enantiomere fest. In der Zeitschrift „Angewandte Chemie“ beschreiben die Wissenschaftler die Trennung der enantiomeren Moleküle (2R, 5R)-2,5-Hexandiol (R-HDO) und (2S, 5S)-2,5-Hexandiol (S-HDO). Ziel weiterer Arbeiten ist, die Maschenweite der porösen Strukturen zu vergrößern, um das Verfahren auch für größere Moleküle zu testen, die als Medikamente eingesetzt werden. „Pharmazeutische Wirkstoffe sind mit Größen von zwei oder mehr Nanometern deutlich größer als Hexandiol. Die Entwicklung von oberflächenverankerten Netzwerke mit so großen Strukturen ist eine große Herausforderung“, erklärt Professor Wöll.
Enormes Potential für die Pharmaindustrie
Ein besonderer Vorteil der SURMOFs ist die Möglichkeit, die Effizienz der Enantiomerentrennung rasch und genau festzustellen. Mithilfe einer Quarzkristallwaage ließ sich zeigen, dass die oberflächenverankerten molekularen Gerüststrukturen schon jetzt hervorragende Trennleistungen erbringen. „Die SURMOFs besitzen als neues Material eine enormes Potential für die Pharmaindustrie“, so Professor Jürgen Hubbuch, Inhaber des Lehrstuhls für Molekulare Aufarbeitung von Bioprodukten (MAB) und Sprecher des KIT-Kompetenzfeldes Biotechnologie.