Mitochondrien-Genom mutiert bei Reprogrammierung
In humanen induzierten pluripotenten Stammzellen stoßen Max-Planck-Forscher auf genetische Veränderungen im Genom der Zellkraftwerke
induzierte pluripotente Stammzellen (iPS-Zellen) sind wahre Multitalente: Sie sind in der Lage, fast alle Zelltypen nachzubilden und daher vielversprechend im Kampf gegen Krankheiten wie Alzheimer oder Parkinson. Doch wäre ihr Einsatz nicht ungefährlich: So können sich während der Reprogrammierung von Körperzellen in iPS-Zellen krankheitsauslösende Mutationen ins Erbgut einschleichen. Das Genom der Mitochondrien – der zellulären Eiweißfabriken – ist dabei besonders gefährdet. Das haben nun Forscher am Berliner Max-Planck-Institut für molekulare Genetik herausgefunden. Im Mitochondrien-Genom von iPS-Zellen stießen die Wissenschaftler auf Mutationen. Da solche genetischen Veränderungen Krankheiten auslösen können, sollten die Zellen vor einem klinischen Einsatz daraufhin getestet werden.
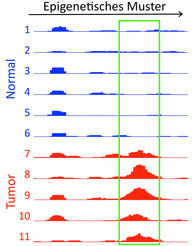
Mutationen im Mitochondrien-Genom von iPS-Zellen
© MPI für molekulare Genetik
Auf induzierten pluripotenten Stammzellen (iPS-Zellen) ruhen viele Hoffnungen: Da sie für jeden Menschen individuell hergestellt werden können, sollen sie etwa die Entwicklung von maßgeschneiderten Therapien ohne das Risiko von Abstoßungsreaktionen ermöglichen. Auch für Medikamenten-Screenings sind iPS-Zellen vielversprechend, da Forscher aus ihnen unterschiedliche Gewebetypen züchten können, um daran die Wirkung von Substanzen zu testen. Über das Verfahren der „zellulären Reprogrammierung“ lassen sich iPS-Zellen aus erwachsenen Körperzellen gewinnen. Die Methode ist ethisch unbedenklich, da keine Embryonen zerstört werden.
Doch bergen die vielversprechenden Zellen auch Gefahren: Während der Umprogrammierung der Körperzellen können krankheitsauslösende Mutationen auftreten. Das genetische Material in den Mitochondrien ist generell besonders anfällig für Veränderungen im genetischen Code. Bisher war jedoch nicht erforscht, ob solche Mutationen infolge der Reprogrammierung auftreten.
Eine Zusammenarbeit zwischen zwei Arbeitsgruppen am Max-Planck-Institut für molekulare Genetik in Berlin hat nun im Mitochondrien-Genom von iPS-Zellen nach Mutationen gefahndet. Die Arbeitsgruppe von James Adjaye hat kürzlich herausgefunden, dass sich die Mitochondrien im Zuge der Reprogrammierung verjüngen. Jetzt konnte dieselbe Arbeitsgruppe in Zusammenarbeit mit der Next Generation Sequencing-Arbeitsgruppe von Bernd Timmermann zeigen, dass bei allen reprogrammierten Zellen genetische Veränderungen im Mitochondrien-Genom vorhanden sind, die in den Ursprungszellen nicht vorhanden waren. Das Ausmaß der Mutationen variierte dabei stark zwischen den einzelnen überprüften iPS-Zellinien. Die Veränderungen betrafen in allen Fällen einzelne Buchstaben im genetischen Code.
„Während der Reprogrammierung wird die mitochondriale Erbsubstanz nach dem Zufallsprinzip neu geordnet“, erklärt James Adjaye. „Dabei können Zelllinien entstehen, die krankheitsauslösende Mutationen in sich tragen. Genetische Veränderungen im Mitochondrien-Genom sind beispielsweise für verschiedene Stoffwechselstörungen, Nervenerkrankungen, Tumore oder Abstoßungsreaktionen nach einer Transplantation verantwortlich. Zelllinien, die für eine klinische Anwendung vorgesehen sind, sollten daher unbedingt auf solche Mutationen getestet werden“, so seine Meinung.
Die Ursache, dass das mitochondriale Erbgut so mutationsanfällig ist, liegt unter anderem darin, dass Mitochondrien nicht über die ausgeklügelten molekularen Reparaturmechanismen des Zellkerns verfügen. Darüber hinaus entstehen während der Zellatmung in den Eiweißfabriken freie Radikale – besonders reaktionsfreudige Moleküle, die Mutationen hervorrufen können.
Für ihre Studie haben die Wissenschaftler iPS-Zellen aus menschlichen Hautzellen (Fibroblasten) hergestellt. Dabei haben sie nach einem Standardverfahren Viren als Vehikel benutzt, um bestimmte Steuerungsgene in die Körperzellen einzuschleusen. Diese Gene, die normalerweise nur im Embryo aktiv sind, versetzen die Zelle in ihren Urzustand zurück. Sie gewinnt somit das Potenzial, in fast alle Zelltypen des menschlichen Körpers auszudifferenzieren, wird also pluripotent.
Wie die Forscher herausfanden, hatten die beobachteten mitochondrialen Mutationen keine Auswirkungen auf das Ergebnis dieses Reprogrammierungs-Vorgangs: Die reprogrammierten iPS-Zelllinien verhielten sich wie normale embryonale Stammzellen, ihr Stoffwechsel schien nicht beeinträchtigt.
Für die klinische Anwendung von iPS-Zellen sind die Befunde von großer Bedeutung. Die Forscher hoffen, dass eines Tages auch Menschen mit mitochondrialen Krankheiten von den Multitalenten profitieren können. Schätzungsweise eine unter 5000 Personen leidet an einer solchen Erkrankung. „Für diese Patienten ließen sich möglicherweise mutationsfreie iPS-Zelllinien gewinnen und zur Therapie einsetzen“, sagt Alessandro Prigione, Erstautor und co-korrespondierender Autor der Studie. „Dazu müssten wir aber sicherstellen, dass die bereits getesteten, mutationsfreien Zellen nicht erneut Mutationen anhäufen, während wir sie in Kultur halten.“