Malaria-Medikament Artesunat aktiviert Krebszell-spezifischen lysosomalen Zelltod
Heidelberger Wissenschaftler untersuchen zelluläre Prozesse beim Abtöten von Brustkrebszellen
Die aus einer Heilpflanze gewonnene Wirksubstanz Artemisinin kann nicht nur in der Malaria-Behandlung, sondern möglicherweise auch in der Krebsbehandlung Anwendung finden. Die zellulären Abläufe beim Abtöten von Brustkrebszellen mit Hilfe von Artesunat, einem Derivat des Artemisinin, haben Wissenschaftler des BioQuant-Zentrums der Universität Heidelberg und des Deutschen Krebsforschungszentrums (DKFZ) untersucht. Sie konnten zeigen, dass membrangebundene Zellorganellen, die sogenannten Lysosomen, und das dort vorhandene reaktive Eisen eine zentrale Rolle beim Artesunat-induzierten programmierten Zelltod der Krebszellen spielen.
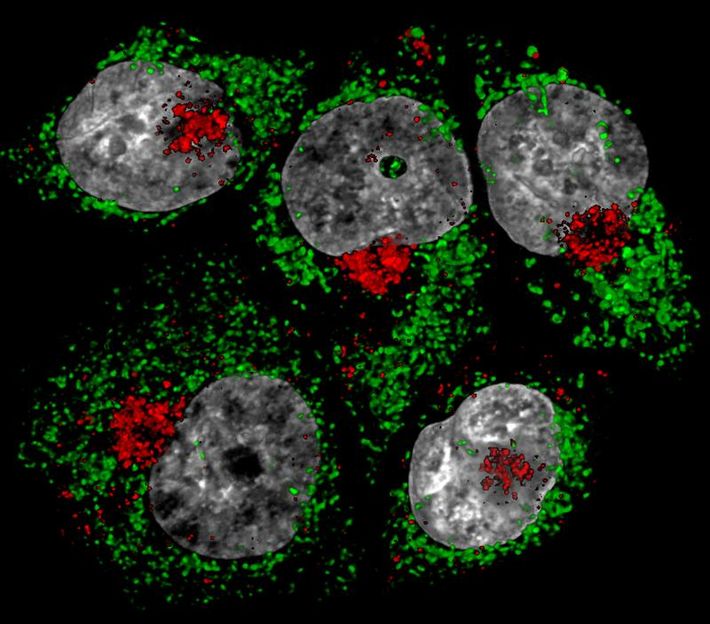
Mit Artesunat behandelte Krebszellen zeigen fragmentierte Mitochondrien (grün) sowie Lysosomen (rot), die sich in der Nähe des Zellkerns angesammelt haben. Unbehandelte Krebszellen weisen demgegenüber typischerweise vernetzte Mitochondrien und durch die gesamte Zelle verteilte Lysosomen auf.
BioQuant-Zentrum
Extrakte der Heilmittelpflanze Einjähriger Beifuß – Artemisia annua L. – werden seit mehr als zweitausend Jahren in der traditionellen chinesischen Medizin eingesetzt. In den 1970er Jahren wurde die Wirksubstanz Artemisinin identifiziert und klinisch als wirksames Mittel gegen Malaria charakterisiert. Heutzutage werden Artemisinine weltweit als Anti-Malaria-Mittel angewendet. Zu den Derivaten gehört das Artesunat, das wie das Artemisinin seine zellabtötende Wirkung durch die chemische Reaktion mit Eisen entfaltet. Dabei entstehen sogenannte reaktive Sauerstoffspezies, die umgangssprachlich auch als freie Sauerstoffradikale bezeichnet werden. In Malariaerregern entfalten sich die toxischen Effekte von Artemisinin in der Nahrungsvakuole des Parasiten, die durch den dort stattfindenden Abbau von Wirts-Hämoglobin hohe Konzentrationen von redox-aktivem Eisen aufweist.
Analog zu den Nahrungsvakuolen des Malariaerregers haben die Heidelberger Wissenschaftler die Lysosomen im Artesunat-induzierten Zelltod bei Brustkrebszellen untersucht. Lysosomen sind von einer Membran umgebene eukaryotische Zellorganellen, die mit Hilfe bestimmter Enzyme zelluläre Komponenten abbauen. Zusätzlich enthalten sie, wie die Nahrungsvakuole der Malariaerreger, größere Konzentrationen von redox-aktivem Eisen. Dieses lysosomale Eisen haben die Wissenschaftler als zentralen Ausgangspunkt für den durch Artesunat ausgelösten Zelltod bei Brustkrebszellen identifiziert. Die Forschergruppe „Systems Biology of Cell Death Mechanisms“ unter der Leitung von Dr. Nathan Brady hat bei ihren Untersuchungen festgestellt, dass die gezielte Blockade von reaktivem Eisen in den Lysosomen die Krebszellen schützt, während andererseits eine Erhöhung des lysosomalen Eisengehalts die schädliche Wirkung von Artesunat für die Krebszellen steigert.
Wie Dr. Anne Hamacher-Brady, wissenschaftliche Mitarbeiterin in der Forschergruppe „Integrative Bioinformatics and Systems Biology“ unter der Leitung von Prof. Dr. Roland Eils erläutert, sind intakte Lysosomen die Voraussetzung dafür, dass das Zelltodsignal an die Mitochondrien weitergeleitet wird. Mitochondrien, normalerweise die „Kraftwerke“ der Zelle, spielen im programmierten Zelltod häufig durch die Freisetzung sogenannter pro-Zelltodmoleküle eine Rolle. Im Zelltod durch Artesunat findet diese Umwandlung der Mitochondrien in Zelltod-Organellen in Abhängigkeit des lysosomalen Eisens statt. Die Wissenschaftler konnten außerdem zeigen, dass das Artesunat durch seinen Einfluss auf die räumliche Verteilung von zellulären Komponenten Prozesse blockiert, die normalerweise das Überleben und die Verbreitung von Krebszellen unterstützen. Dazu gehört unter anderem der Vorgang der Autophagie, bei dem die Zelle eigene Bestandteile lysosomal abbaut und damit in Situationen mit begrenzter Nährstoffzufuhr, wie zum Beispiel im Inneren eines Tumors, überlebenswichtige Makromoleküle recycelt.
Nach Angaben der Heidelberger Wissenschaftler wurde der Zelltod durch Artesunat nur in Brustkrebs-Zelllinien und nicht in „gesunden“ Brustepithel-Zelllinien ausgelöst. Ihre Hypothese ist, dass diese Selektivität gegenüber Krebszellen ihre Ursache darin haben könnte, dass die Krebszellen durch einen veränderten Stoffwechsel einen erhöhten Bedarf an Eisen aufweisen. Dies ist Gegenstand aktueller Untersuchungen der beiden Forschergruppen am BioQuant-Zentrum.






















































