Pluripotenz im Schlummer-Modus
Embryozellen bleiben auf ihrem Entwicklungsweg länger Alleskönner als bisher vermutet
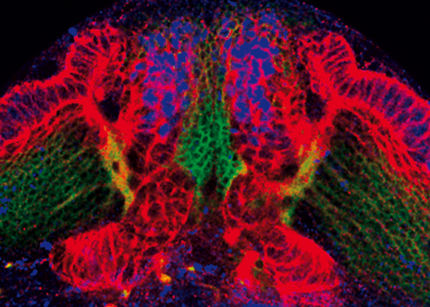
Epiblast-Stammzellen (EpiSC) geben Wissenschaftlern seit längerem ein Rätsel auf. Wie embryonale Stammzellen können sie zwar jeden der über 200 Zelltypen des Körpers bilden. Auch sie gelten deshalb als pluripotent. Doch in einem entscheidenden Test für zelluläre Alleskönner haben EpiSC bislang weitgehend versagt: Sie sind kaum in der Lage, so genannte Chimären zu bilden. Wissenschaftler vom Max-Planck-Institut (MPI) für molekulare Biomedizin in Münster konnten jetzt jedoch zeigen, dass diese Fähigkeit in EpiSC nur schlummert - und dass sie sich gezielt aktivieren lässt. Über diesen Fund, der möglicherweise auch für eine spätere Therapie mit Stammzellen wichtig ist, berichtet das Team um Dong Wook Han und Hans Schöler in der Fachzeitschrift Cell.
Vor drei Jahren präsentierten britische Forscher der Weltöffentlichkeit eine kleine Sensation: Dem Team um Gabrielle Brons war es gelungen, eine neue Art von pluripotenten Zellen aus Embryonen von Mäusen zu isolieren und diese im Labor zu vermehren. Anders als ‚klassische’ embryonale Stammzellen hatten die Forscher die so genannten Epiblast-Stammzellen nicht aus sehr frühen Embryonen im Stadium der so genannten Blastozyste gewonnen. Die neuen EpiSC stammten aus Embryonen, die sich bereits weiterentwickelt und in die Gebärmutter eingenistet hatten, im Fachjargon Epiblasten genannt.
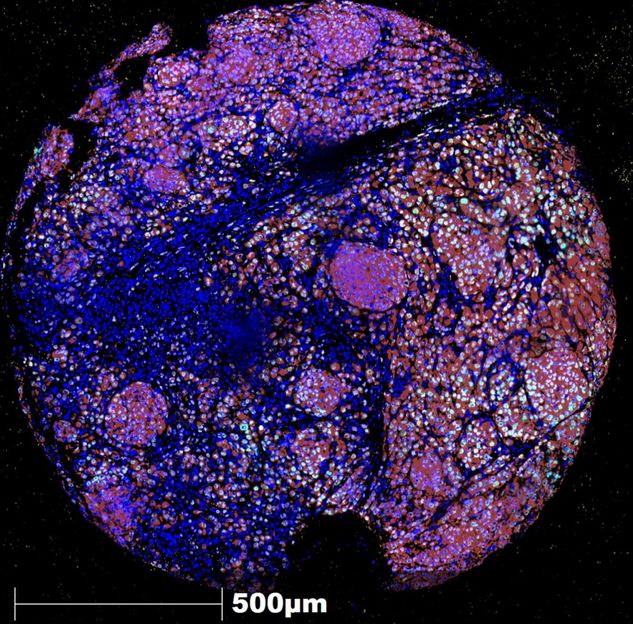
Seither sorgen Epiblast-Stammzellen für reichlich Verwirrung. Denn obwohl der Embryo, aus dem sie stammen, bereits ein gutes Stück in seiner Entwicklung fortgeschritten ist, gelten sie als Alleskönner. Schließlich bestehen sie fast alle Tests, mit denen Pluripotenz nachgewiesen wird. So sind EpiSC - erstens - in der Lage, alle Zelltypen des Körpers hervorzubringen. Sie können - zweitens - auch Teratome bilden. Bei diesem Test spritzt man die fraglichen Zellen unter die Haut lebender Mäuse. Sind die Zellen pluripotent, bilden sich aus ihnen charakteristische Tumore, so genannten Teratome. Wichtig für den Pluripotenz-Nachweis ist, dass der entstandene Tumor eine Mischgeschwulst ist und Zelltypen aller drei Keimblätter enthält. Dabei handelt es sich um unterschiedliche Zellschichten, die bei der ersten Differenzierung des Embryos entstehen. Damit schlagen die Zellen eine Richtung ein, in die sie sich später entwickeln werden.
Beim dritten Funktions-Check jedoch - der Prüfung auf die Fähigkeit Chimären zu bilden - fallen EpiSC fast immer durch. Darin testen Forscher, ob die fraglichen Zellen in der Lage sind, sich in einen frühen Embryo zu integrieren und gemeinsam mit diesem einen kompletten Organismus aufzubauen. Dazu injiziert man die Zellen in eine intakte Blastozyste und setzt diese anschließend in die Gebärmutter einer weiblichen Maus ein. Gelingt die Prozedur, kommt am Ende eine gesunde junge Maus auf die Welt, deren Körper sich aus genetisch unterschiedlichen Zellen zusammensetzt.
Fast alle bisherigen Versuche von Forschern, aus EpiSC Chimären zu bekommen, schlugen fehl. Von rund 300 Anläufen klappte im Schnitt gerade einmal einer. „Normalerweise sagt man in so einem Fall: Okay, dann können die Zellen das eben nicht“, berichtet Dong Wook Han, der Erst- Autor der neuen Studie. Aber warum, fragte sich der Biologe, schaffen es einige der Zellen dann doch? Könnte es sein, dass sich die vielen tausend Zellen, die sich in einer Kulturschale befinden - auch wenn sie alle aus einem einzigen Epiblast stammen - in Wirklichkeit nicht alle gleich „ticken“?
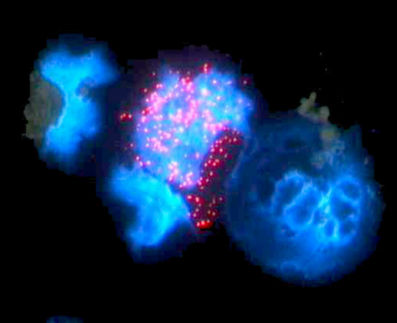
Offenbar, stellten Han und seine Kollegen fest, ist genau das der Fall. Mit Hilfe eines Marker-Gens namens Oct4-GFP entdeckten sie, dass es in jeder EpiSC-Kultur zwei unterschiedliche Gruppen von Zellen gibt: In den weitaus meisten Zellen ist das Gen inaktiv. In der zweiten Gruppe, die nur 0,5 Prozent der Zellen ausmacht, ist es dagegen eingeschaltet.
Weitere Analysen zeigten, dass in den beiden Gruppen von Zellen unterschiedliche Sets von Genen aktiv sind und dass die Zellen über unterschiedliche Fähigkeiten verfügen. Jene wenigen Zellen, in denen das eingebrachte Fluoreszenz-Gen aktiv ist, entsprechen einem frühen Stadium der Embryonalentwicklung - und können nahezu problemlos Chimären bilden. Die große Gruppe der anderen Zellen aber hat bereits den Weg in Richtung Spezialisierung eingeschlagen. Sie sind in ihrem Entwicklungsstadium ungefähr einen Tag weiter als die anderen Zellen - und bringen keine Chimären hervor.
Das Verblüffendste an der Entdeckung der Max-Planck-Forscher war jedoch, dass die Zellen genau diesen Mix von einer frühen und einer späten Gruppe offenbar selbst „wollen“. Wie Han und sein Team nachweisen konnten, sind EpiSC-Zellen nämlich in der Lage, von dem einen Zustand in den anderen zu switchen. Das tun sie zum Beispiel, wenn man die Zellen, in denen Oct4-GFP aktiv ist, von denen trennt, in denen es schlummert. Die „Aktiven“ beginnen dann, innerhalb von 48 Stunden ihre Marker-Gen-Aktivität zu verlieren. Und von den „Inaktiven“ schalten einige auf einmal wieder ihr Marker-Gen an. Innerhalb einer Woche haben beide den ursprünglichen Zustand erreicht: Am Ende ist das Oct4-GFP-Gen in beiden Kulturen wieder nur in 0,5 Prozent der Zellen aktiv.
Möglicherweise, hofft die Arbeitsgruppe um Hans Schöler, lässt sich dieser Switch-Mechanismus gezielt steuern und die Quote der rundum pluripotenten gegenüber den eingeschränkt pluripotenten Zellen erhöhen. Erste Hinweise darauf haben die Münsteraner bereits gefunden.
Interessanterweise scheinen humane embryonale Stammzellen zum Zeitpunkt ihrer Generierung eher EpiSC-Zellen der Maus zu entsprechen als „klassischen“ embryonalen Stammzellen der Maus. Wenigstens in ihrer Morphologie ähneln humane embryonale Stammzellen EpiSC-Zellen der Maus. In künftigen Untersuchungen wollen die Forscher herausfinden, ob auch Kulturen von menschlichen embryonalen oder induziert pluripotenten Stammzellen in Wirklichkeit inhomogen sind, also aus zwei verschiedenen Gruppen von Zellen bestehen. „Dies zu wissen ist wichtig für den therapeutischen Einsatz solcher Zellen. Denn nur dann lassen sie sich mit bestimmten Wachstumsfaktoren gezielt steuern, um so Nerven-, Muskel- oder Bindegewebszellen zu erhalten“, sagt Schöler.
Originalveröffentlichung: Don Wook Han, Natalia Tapia, Jin Young Joo, Boris Greber, Marcos J. Araúzo-Bravo, Christof Bernemann, Kinarm Ko, Guangming Wu, Martin Stehling, Jeong Tae Do, Hans R. Schöler; "Epiblast stem cell subpopulations represent mouse embryos of distinct pregastrulation stages"; Cell 143 (4), 12. November 2010