Das Hepatitis-D-Virus besser verstehen
Hannoveraner Forscher entwickeln Stammzell-basiertes Infektionsmodell
Das Hepatitis-D-Virus (HDV) befällt die Leber und verursacht dort schwere Entzündungen. Nach Schätzungen der WHO sind weltweit 12 Millionen Menschen mit HDV infiziert. Derzeit gibt es nur wenige Behandlungsmöglichkeiten. Ein Forscherteam vom TWINCORE, Zentrum für Experimentelle und Klinische Infektionsforschung in Hannover, hat ein Stammzell-basiertes Infektionsmodell für HDV entwickelt und damit einen möglichen Angriffspunkt gegen das Virus entdeckt. Ihre Ergebnisse veröffentlichen sie in JHEP Reports.
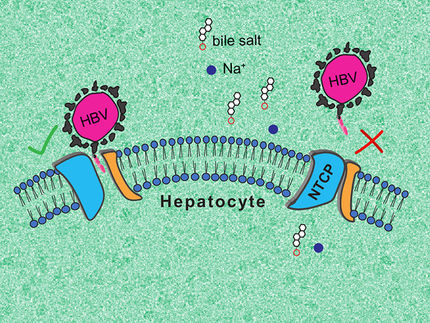
Das Hepatitis-D-Virus ist ein so genanntes Satellitenvirus. Sein genetischer Bauplan enthält nur ein einziges Protein, und als Hülle verwendet es Bestandteile des Hepatitis-B-Virus (HBV). Deshalb ist es auf das Vorhandensein von HBV angewiesen, und die Hepatitis-B-Impfung schützt auch gegen HDV. Von allen Hepatitisviren verursacht HDV jedoch die schwersten Erkrankungen. Neben der bisherigen Therapie mit Interferon-alpha steht seit kurzem mit Hepcludex ein Medikament zur Verfügung, das HDV wirksam am Eindringen in die Leberzellen hindern kann. Hepcludex hat jedoch keine antivirale Wirkung und kann nicht verhindern, dass bei der Teilung infizierter Leberzellen auch die Tochterzellen das Virus tragen. Die Forschung sucht deshalb nach neuen antiviralen Wirkstoffen für eine Kombinationstherapie.
Dr. Arnaud Carpentier, Postdoktorand am Institut für Experimentelle Virologie des TWINCORE, ist Experte für stammzellbasierte Infektionsmodelle und hat nun ein solches zur Untersuchung von HDV-Infektionen entwickelt. „Unser auf Stammzellen basierendes Zellkultursystem eignet sich hervorragend als Infektionsmodell für HDV“, sagt Carpentier. „Die Zellen sind nahezu identisch mit primären Leberzellen und bieten daher realistischere Bedingungen als die bisher in der Hepatitis-Forschung verwendeten Leberzelllinien.“
Um einen genaueren Einblick in die Vorgänge während der HDV-Infektion zu erhalten, haben Carpentier und sein Team die Genaktivität in den infizierten Zellen genauer untersucht. Dazu nutzten sie die so genannte Einzelzellsequenzierung. „Anhand der Sequenzierung können wir die Zellen in zwei Gruppen einteilen“, sagt Frauke Lange, Doktorandin in Carpentiers Team. „In einem Teil der infizierten Zellen repliziert das Virus, in der anderen Hälfte kann es sich nicht vermehren.“ Die Ergebnisse der Sequenzierung zeigten einen entscheidenden Unterschied zwischen den beiden Zellpopulationen: Die Expression des Gens IRF1.
IRF1 steht für Interferon Regulatory Factor 1. „IRF1 ist ein Transkriptionsfaktor, der bei der zellulären Immunabwehr eine Rolle spielt“, sagt Carpentier. „Er reguliert 101 nachgeschaltete Gene.“ Carpentier hofft, dass darunter auch Kandidaten sind, die antiviral gegen HDV wirken. „Deshalb wollen wir in Zukunft die von IRF1 regulierten Gene genauer unter die Lupe nehmen.“ Die aktuellen Ergebnisse ebnen den Weg für eine effektivere Behandlung von HDV-Infektionen.
Unterstützt wurde die Arbeit auch durch den Exzellenzcluster RESIST sowie durch Mittel der Deutschen Forschungsgemeinschaft (DFG), die Prof. Thomas Pietschmann, Leiter des Instituts für Experimentelle Virologie, eingeworben hat.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.