Funktion eines bisher rätselhaften HIV-Bausteins entdeckt
Forschende gewinnen neue Erkenntnisse darüber, wie die Matrixschicht von HIV-1 reift
Forschende des Max-Planck-Instituts für Biochemie haben den Mechanismus hinter einem wichtigen Schritt im Lebenszyklus von HIV entdeckt. In Zusammenarbeit mit Teams der Universitäten Heidelberg und Yale fanden sie heraus, dass das rätselhafte „Spacer Peptid 2“, einer der Virusbestandteile, eine Schlüsselrolle bei der Umwandlung unreifer HIV-1-Partikel in infektiöse Partikel spielt. Die Ergebnisse der Studie wurden in der Fachzeitschrift Nature veröffentlicht.
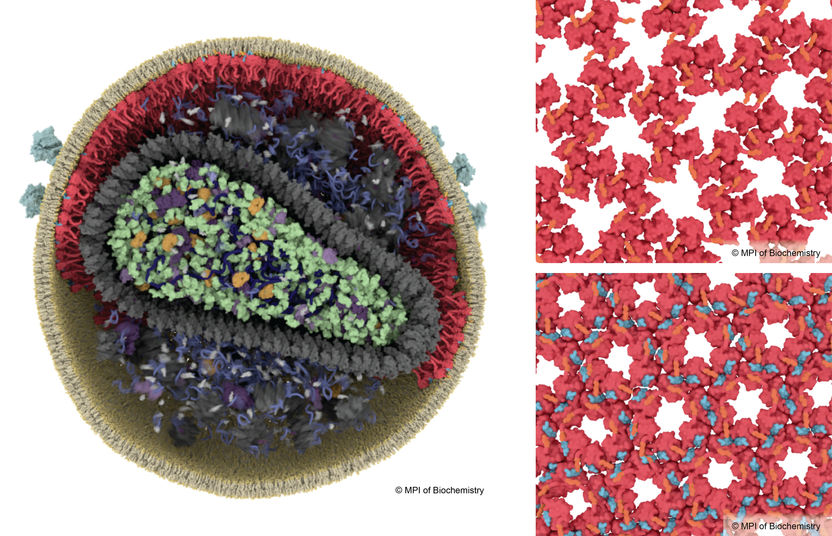
Damit HIV infektiös wird, muss es einen Reifungsprozess durchlaufen. Beim unreifen HIV bilden Matrixproteine (rot) ein loses Gitter (o.r.), während beim reifen HIV die Bildung eines stabilen Gitters durch das Protein SP2 (blau, u.r.) ausgelöst wird.
Margot Riggi, MPI of Biochemistry
HIV-1-Partikel (engl. Human Immunodeficiency Virus) werden in einer unreifen, nicht infektiösen Form aus infizierten Zellen freigesetzt. Das Hauptbaumaterial für ein Viruspartikel sind etwa 2000 Kopien eines langen, stabförmigen Proteins namens Gag. Um infektiös zu werden, muss HIV einen Reifungsprozess durchlaufen. Dabei kommt die HIV-1-Protease (ein virales Enzym) zum Einsatz, die Gag in sechs kleinere Proteine, darunter das Kapsid- und das Matrixprotein, zerschneidet. Dies führt zu einer umfangreichen strukturellen Neuanordnung der Virusbestandteile.
Seit vielen Jahren erforschen Wissenschaftler*innen die strukturellen Umwandlungen des Viruskapsids, das das Virusgenom umhüllt. Im Gegensatz dazu ist über die Virusmatrix – die äußere Proteinhülle direkt unter der Lipidmembran, die das Virus umgibt – weitaus weniger bekannt. Forschende unter der Leitung von John Briggs, Direktor und Strukturbiologe am Max-Planck-Institut für Biochemie, haben nun herausgefunden, wie sich die Matrixproteine während der Reifung zum infektiösen Partikel neu anordnen.
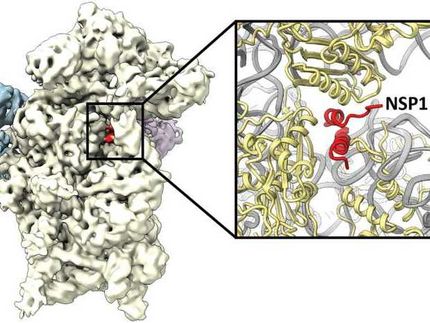
Die Forscherinnen und Forscher verwendeten modernste Kryo-Elektronenmikroskope, um die Viruspartikel sichbar zu machen, und erstellten dann mit Hilfe computergestützter Bildanalyse sehr detaillierte 3D-Modelle der Virusproteine. Dabei entdeckten sie entgegen ihren Erwartungen, dass die Umordnung der Matrix durch das „Spacer-Peptid 2“ ausgelöst wird, das an die Matrix bindet und sie neu anordnet. Spacer-Peptid 2 ist ein weiterer der sechs Bausteine, die durch das Schneiden von Gag entstehen, dessen Funktion aber bisher unbekannt war. Durch die Bindung von Spacer-Peptid 2 an das Matrixprotein kann das Virus schneller mit den zu infizierenden Wirtszellen verschmelzen. Die Arbeiten wurden gemeinsam mit Partnern der Universität Heidelberg und der Yale University, USA, durchgeführt.
John Briggs erklärt: „In unserem Labor haben wir 2021 die ersten Strukturdaten über die Virusmatrix ermittelt, aber wir wussten nicht, was die Umstrukturierung der Matrix bei der Reifung des Virus verursacht. In dieser neuen Studie haben wir wesentlich detailliertere 3D-Ansichten der Matrixschicht erstellt, die für das Verständnis der viralen Umbauprozesse wichtig waren.“
James Stacey und Dominik Hrebík, die beiden Erstautoren der Studie, erläutern ihre Ergebnisse. James erklärt: „Die Virusmatrix hat in ihrer reifen Form eine Vertiefung. Wir wussten, dass dort etwas bindet, dachten aber, es handele sich um ein Lipidmolekül aus der Membran. Jetzt konnten wir zeigen, dass es sich um das Spacerpeptid 2 handelt. Es stellt sich die Frage, ob diese Vertiefung in Zukunft ein Ziel für Wirkstoffmoleküle sein könnte.“ Dominik ergänzt: „Bisher war die Funktion des Spacerpeptids 2 nicht bekannt. Dank der hochauflösenden Kryo-Elektronenmikroskopie haben wir gesehen, dass dieses Peptid nach seiner Freisetzung direkt an die Matrixproteine bindet und die Proteine im reifen Virus miteinander verbindet.“
John Briggs fasst zusammen: „HIV-1 ist wahrscheinlich das am besten untersuchte Virus, aber es gibt immer noch wichtige Schritte in seiner Vermehrung, die wir noch nicht verstehen.“
Originalveröffentlichung
James C. V. Stacey, Dominik Hrebík, Elizabeth Nand, Snehith Dyavari Shetty, Kun Qu, Marius Boicu, Maria Anders-Össwein, Pradeep D. Uchil, Robert A. Dick, Walther Mothes, Hans-Georg Kräusslich, Barbara Müller, John A. G. Briggs; "The conserved HIV-1 spacer peptide 2 triggers matrix lattice maturation"; Nature, 2025-2-26