Molekulare Gartenarbeit: Neue Enzyme für Proteinmodifikation entdeckt
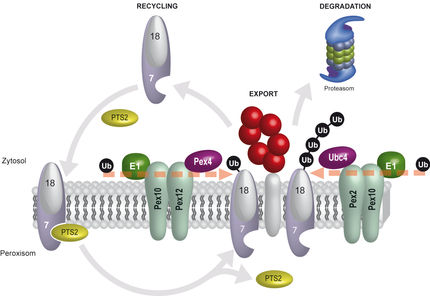
Deubiquitinasen (DUBs) sind Enzyme, die von Zellen verwendet werden, um Proteinmodifikationen aus dem Protein Ubiquitin zu kürzen und so Proteine zu regulieren. Fehlfunktionen von DUBs können zu Krankheiten wie Krebs und neurodegenerativen Störungen führen. Erst kürzlich wurde die DUB USP53 mit progressiver familiärer intrahepatischer Cholestase in Verbindung gebracht, einer erblichen Lebererkrankung bei Kindern. Der Wirkmechanismus von USP53 ist noch nicht geklärt. Aufgrund seiner Sequenz gehörte es zwar zur Familie der Deubiquitinasen, doch frühere Versuche, eine katalytische Aktivität nachzuweisen, waren ergebnislos geblieben. Nun hat ein Team unter der Leitung von Malte Gersch, Gruppenleiter am Max-Planck-Institut für Molekulare Physiologie, zusammen mit Forschenden der Technischen Universität Dortmund und des Erasmus University Medical Center in Rotterdam die Wirkungsweise von USP53 und seinem verwandten Enzym USP54 entschlüsselt. Die Forschenden fanden heraus, dass beide Enzyme spezifisch lange Polyubiquitinketten von Proteinen entfernen. Sie identifizierten auch die Proteine, auf die USP53 einwirkt und die mit der Lebererkrankung in Verbindung gebracht werden könnten. Die Ergebnisse könnten dabei helfen, eine gezielte Behandlung für solche Krankheiten zu identifizieren.
Zellen wenden einen einfachen Trick an, um Proteine für bestimmte Funktionen wie Abbau, DNA-Reparatur oder Entzündungsreaktion zu modifizieren. Sie markieren sie mit einem oder mehreren kleinen Proteinen, den sogenannten Ubiquitinen. Umgekehrt können Zellen diese auch entfernen. „Unsere Forschung konzentriert sich auf Proteine, die diese Markierungen entfernen, sogenannte Deubiquitinasen“, sagt Kai Gallant, einer der Erstautoren der Publikation. Beim Menschen gibt es etwa 100 DUBs, wobei Ubiquitin-spezifische Proteasen (USP) die größte Familie bilden. Bisher bezeichneten Forschende USP53 und USP54 als „inaktiv“, da sie nur eine geringe katalytische Aktivität gegenüber Ubiquitin zeigten. „Mutationen im USP53-Gen werden jedoch mit Cholestase bei Kindern in Verbindung gebracht, was uns dazu veranlasste, sie zu untersuchen“, fügt Gallant hinzu.
Den Mechanismus analysieren
Die MPI-Forschenden testeten USP53 und USP54 mit unterschiedlich langen Polyubiquitinketten. Bevorzugt wurden lange Polyubiquitinketten gespalten, die auch als K63-verknüpft bezeichnet werden und eine von acht Varianten von Ubiquitinketten darstellen. „Das war überraschend, da kein anderes menschliches USP-Enzym eine solche Präferenz für eine bestimmte Verknüpfung zeigt“, sagt Kim Wendrich, die das Projekt initiierte und auch Erstautorin der Publikation ist. Ihre Arbeit ergab, dass USP53 und USP54 unterschiedliche Trimmtechniken verwenden: USP53 entfernt die vollständigen K63-verknüpften Ketten von den Substratproteinen, während USP54 sie verkürzt. Beide Deubiquitinasen haben zusätzlich zu den üblichen S1-Stellen eine katalytische S2-Domäne, die ihre Fähigkeit zur Erkennung längerer Ketten verbessert.
Ein krankheitsrelevantes Ziel finden
Schließlich suchten die Forschenden nach ubiquitinierten Proteinen, die den Zusammenhang zwischen dem Enzym USP53 und der Cholestase erklären könnten. Frühere Untersuchungen ergaben, dass Mutationen in USP53 oder Proteinen, die für Zellverbindungen wichtig sind, wie Tricellulin und LSR, ähnliche Cholestase-Symptome verursachen können. In Zusammenarbeit mit dem Team in Rotterdam setzten die MPI-Forschenden unter anderem proteomische Methoden ein, um ubiquitinierte Tricellulin- und LSR-Proteine aus Zellen zu isolieren, und bestätigten, dass sie durch USP53 deubiquitiniert werden. Sie vermuten, dass das Unvermögen, Ubiquitin von diesen Proteinen zu entfernen, mit der Krankheit zusammenhängt. „Unsere Ergebnisse fügen dieser Gruppe von Proteinen nicht nur zwei zusätzliche Enzyme mit neuartigen Wirkungsweisen hinzu, sondern zeigen auch, wie eine gezielte Behandlung für Krankheiten gefunden werden könnte, bei denen die Ubiquitinierung eine entscheidende Rolle spielt“, sagt Malte Gersch.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Kim Wendrich, Kai Gallant, Sarah Recknagel, Stavroula Petroulia, Nafizul Haque Kazi, Jan André Hane, Siska Führer, Karel Bezstarosti, Rachel O’Dea, Jeroen Demmers, Malte Gersch; "Discovery and mechanism of K63-linkage-directed deubiquitinase activity in USP53"; Nature Chemical Biology, 2024-11-25
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Barry_Marshall
Kategorie:Krankheitsbild_in_der_Urologie

Wie der Mensch die Luft in Innenräumen beeinflusst - Die Art und Weise, wie wir leben, beeinflusst die Chemie in Innenräumen
Analytica 2014: Lebensmittel-, Kunststoffanalytik sowie Gen- und Bioanalytik stehen im Fokus
Wenn Spinnengift die Nerven angreift - Neurotoxin der Schwarzen Witwe untersucht
Per Anhalter zum Einsatzort - Serum-Albumin als natürlicher Transporter für den Lipid-konjugierten antineoplastischen Wirkstoff Floxuridin

Maßgeschneiderte Beschichtungen gegen resistente Bakterien und Viren, einschließlich SARS-CoV-2 - Spartha Medical erhält Finanzierung in Höhe von 2,4 Millionen Euro vom Europäischen Innovationsrat

Enzyme in Spinnengiften zeigen bioökonomisch nutzbares Potenzial - Erstaunliche Entdeckung: Chemische Vielfalt in Spinnengiften bisher dramatisch unterschätzt
BIOTECHNICA 2011 geht kraftvoll an den Start - Messe übertrifft Vorveranstaltung in 2010

Wie Bauernhöfe vor Asthma im Kindesalter schützen - Darmmikrobiom von Kindern am Schutzprozess beteiligt
Krebs natürlich töten - Wissenschaftler haben eine Methode zur Kombination natürlicher organischer Verbindungen aufgedeckt, mit der Krebsmedikamente mit minimalen Nebenwirkungen hergestellt werden können