Eine einzige Base entscheidet zwischen „An“ und „Aus“
Innsbrucker Chemiker klären in nie dagewesener Präzision auf, wie ein bakterieller Riboschalter funktioniert
Bakterielle Riboschalter sind nicht nur interessante Ziele für neuartige Antibiotika. Sie könnten in Zukunft auch dazu verwendet werden, Bakterien „umzuprogrammieren“, um Umweltgifte zu vernichten. Für beide Anwendungen ist es zunächst nötig, die Funktionsweise natürlicher Riboschalter besser zu verstehen. Auf diesem grundlegenden Forschungsgebiet ist Innsbrucker Chemikern nun ein großer Fortschritt gelungen.
Riboschalter sind multifunktionelle Boten-RNAs (messenger RNAs), die nicht nur den Code eines Genprodukts transportieren, sondern gleichzeitig als Sensor und als Schalter dienen können. Mit ihrer Hilfe messen Bakterien die Konzentration lebenswichtiger Stoffwechselprodukte und passen ihre Produktionsmaschinerie dem aktuellen Bedarf an. Bindet das Stoffwechselprodukt an das eine Ende des Riboschalters, faltet sich das andere blitzschnell um und blockiert so die weitere Synthese des Biomoleküls.
Doch woher „weiß“ das eine Ende, was das andere tut? Wie funktioniert die Kommunikation innerhalb der RNA? Chemiker um Prof. Ronald Micura vom Center for Molecular Biosciences (CMBI) der Universität Innsbruck sind diesen Fragen nachgegangen und haben das Umfalten eines Riboschalters in bisher unerreichter Auflösung analysiert. Sie kommen zu einer verblüffenden Erkenntnis: Eine einzige Nukleotidbase entscheidet über den Zustand des Schalters. Die soeben in PNAS veröffentlichte Arbeit fand im Rahmen des GEN-AU-Projekts zu nichtkodierenden RNAs statt, das von der Innsbrucker Firma CEMIT gemanagt wird, und wurde auch vom Wissenschaftsfonds FWF gefördert.
Untersuchungsobjekt war der kleinste bisher bekannte Riboschalter namens preQ1. Dieser Mini-Riboschalter kommt in verschiedenen Bakterien vor, darunter Fusobacterium nucleatum, das in der Mund- und Darmflora des Menschen auftritt und Infektionen verursachen kann. Er reguliert die Fähigkeit, das für Bakterien lebenswichtige Molekül Queuosin herzustellen, indem er die Konzentration eines Vorläuferprodukts namens preQ1 misst. Ulrike Rieder aus Micuras Gruppe stellte chemisch markierte Riboschalter für die Fluoreszenz- und NMR-Spektroskopie her. Die große Kunst des Labellings ist dabei, die Struktur der RNA so wenig wie irgend möglich zu verändern. Mit Hilfe ausgeklügelter Verfahren konnten die Wissenschaftler einzelne Nukleotidbasen markieren und erkennen, wie sich deren Positionen beim Umfalten des Schalters verändern.
So fanden sie heraus, dass die Bindung von preQ1 eine bestimmte Nukleotidbase blockiert, die dadurch nicht mehr für die charakteristische Faltung des „An-Zustands“ zur Verfügung steht. Der „Aus-Zustand“ des Schalters wird durch das Vorhandensein von preQ1 jedoch nicht beeinflusst, so dass sich das Gleichgewicht beider Schalterstellungen zu dessen Gunsten verschiebt. Die Kommunikation zwischen der Bindestelle und der Schalterfunktion läuft also über diese eine, entscheidende Nukleotidbase.
Die Riboschalter-Forschung könnte in Zukunft auch praktische Anwendungen finden. So wurde diese Form der Gen-Regulation beim Menschen bisher nicht nachgewiesen. Das macht sie für die Pharma-Industrie interessant: Denn die Blockade von für Mikroben lebenswichtigen Riboschaltern könnte eine neue Klasse von Antibiotika erschließen - ohne die Vorgänge in menschlichen Zellen zu stören.
Auch synthetische Biologen interessieren sich für Riboschalter. So ist es kürzlich gelungen, einen künstlichen Riboschalter in E. coli Bakterien einzubauen, der sie dazu veranlasst, das Herbizid und Umweltgift Atrazin aufzuspüren und abzubauen.
Originalveröffentlichung: Rieder et al.; "Folding of a transcriptionally acting PreQ1 riboswitch", PNAS, online-Ausgabe
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
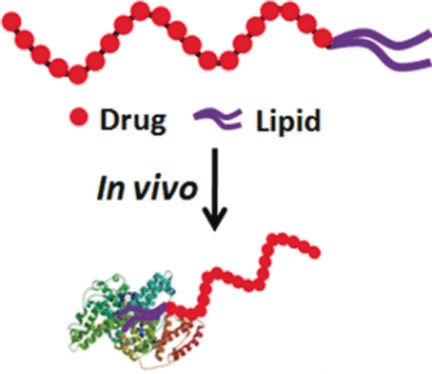
Per Anhalter zum Einsatzort - Serum-Albumin als natürlicher Transporter für den Lipid-konjugierten antineoplastischen Wirkstoff Floxuridin

Maßgeschneiderte Beschichtungen gegen resistente Bakterien und Viren, einschließlich SARS-CoV-2 - Spartha Medical erhält Finanzierung in Höhe von 2,4 Millionen Euro vom Europäischen Innovationsrat

Enzyme in Spinnengiften zeigen bioökonomisch nutzbares Potenzial - Erstaunliche Entdeckung: Chemische Vielfalt in Spinnengiften bisher dramatisch unterschätzt
BIOTECHNICA 2011 geht kraftvoll an den Start - Messe übertrifft Vorveranstaltung in 2010

Wie Bauernhöfe vor Asthma im Kindesalter schützen - Darmmikrobiom von Kindern am Schutzprozess beteiligt
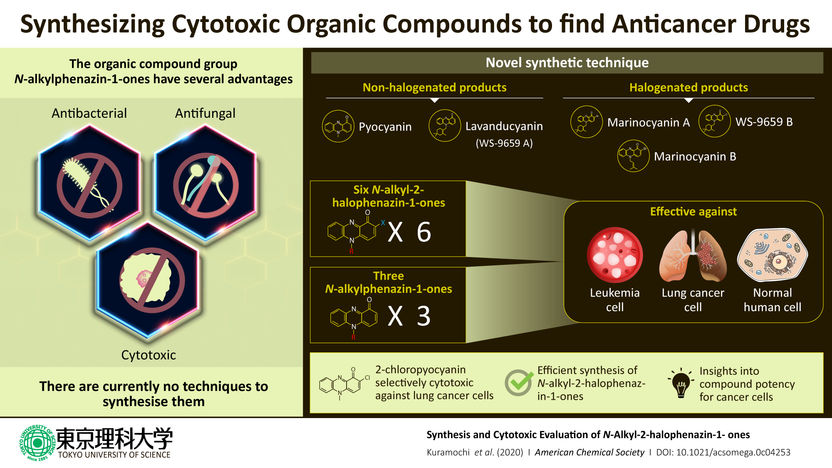
Krebs natürlich töten - Wissenschaftler haben eine Methode zur Kombination natürlicher organischer Verbindungen aufgedeckt, mit der Krebsmedikamente mit minimalen Nebenwirkungen hergestellt werden können