Chemiker imitieren natürliche Molekülstrukturen: Neue Möglichkeit der Impfstoff-Entwicklung
Fluorierte Zuckermoleküle als Leitstruktur für Impfstoff gegen Meningitis B und C
Meningokokken (Neisseria meningitidis) sind krankheitsverursachende Bakterien, die Meningitis, eine lebensgefährliche Hirnhautentzündung, oder eine Blutvergiftung (Septikämie) auslösen können. Weltweit gibt es eine Reihe von Meningokokken-Varianten, sogenannte Serogruppen. Die Ständige Impfkommission (STIKO) empfiehlt in Deutschland eine Impfung gegen die Serogruppen B und C bei Kindern. Ein Team der Universität Münster (unter der Leitung von Prof. Dr. Ryan Gilmour) und des Max-Planck-Instituts (MPI) für Kolloid- und Grenzflächenforschung in Potsdam (Leitung: Prof. Dr. Peter H. Seeberger) hat nun eine kombinierte Impfstoff-Leitstruktur aus synthetischen fluorierten Zuckermolekülen entwickelt, die gegen beide Stämme gleichzeitig wirkt. Als Leitstruktur wird die Komponente des Impfstoffes bezeichnet, die die gewünschte Immunantwort auslöst. Die Studie ist im „Journal of the American Chemical Society” veröffentlicht.
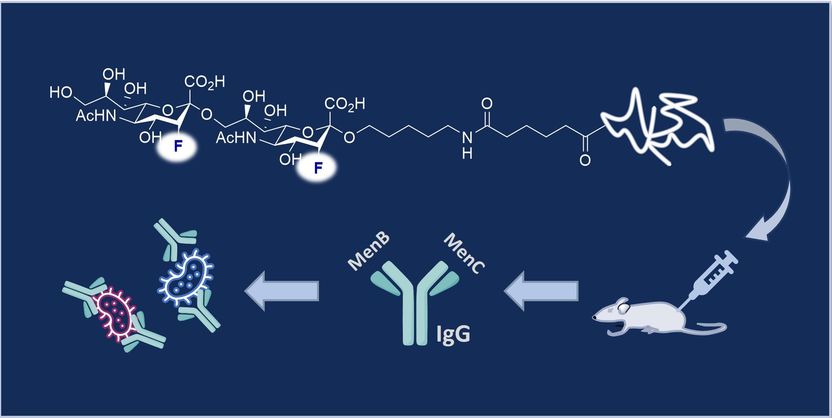
Chemiker der Universität Münster und des Max-Planck-Instituts (MPI) für Kolloid- und Grenzflächenforschung in Potsdam haben eine kombinierte Impfstoff-Leitstruktur aus synthetischen fluorierten Zuckermolekülen entwickelt, die gegen Meningokokken B und C gleichzeitig wirkt.
© AK Gilmour
Die Einführung von Fluor in die natürliche Molekülstruktur bringt viele Vorteile mit sich, angefangen bei der Vereinfachung der Synthese und Analyse bis hin zur Verbesserung der metabolischen Stabilität, also der Resistenz gegenüber dem Abbau durch Stoffwechselprozesse. In dieser Machbarkeitsstudie wiesen die Wissenschaftler die Wirksamkeit der Leitstruktur in Zellkulturtests und bei Mäusen nach.
Zur Herstellung der Impfstoff-Leitstruktur ahmte das Team den molekularen Fingerabdruck des bakteriellen Kapselpolysaccharid-Epitops nach („molekulare Mimikry“). Diese Polysaccharide bilden eine Hülle um die Bakterien, und ihre einzigartige Struktur ermöglicht es, dass sie als sogenannte Antigene gezielt von der Immunreaktion angesprochen werden. Diese hochspezifische Form der molekularen Erkennung ist die Grundlage für einen Impfstoff. Das Team synthetisierte eine molekulare Struktur, die dem Epitop auf der Oberfläche der natürlichen Polysaccharid-Kapsel sehr ähnlich ist, und kombinierte sie mit einem Trägerprotein. Weitere Untersuchungen zeigten, dass dieses Epitop-Analogon bei Mäusen eine Immunreaktion gegen die Serogruppen B und C auslösen kann.
Die Synthese des Zielmoleküls – ein difluoriertes Analogon des in der Natur vorkommenden α-(2,9)-Sialinsäure-Epitops – erforderte 16 Schritte und wurde von Dr. Christina Jordan und Doktorandin Kathrin Siebold am Institut für Organische Chemie der Universität Münster durchgeführt. „Es hat viele Vorteile, das Schlüsselmolekül durch eine präzise Synthese herzustellen, anstatt es aus biologischen Quellen zu isolieren. Der offensichtlichste ist, dass die Synthese skaliert werden kann und man sicher sein kann, dass der Impfstoff nur die gewünschte Molekülstruktur enthält“, sagt Ryan Gilmour. „Die genaue Zusammensetzung ist bekannt und analytisch validiert. Außerdem ist die Methode schneller und günstiger als die Isolierung von nativem Kapselpolysaccharid. Wir glauben, dass dies bedeutende Verbesserungen sind. Wir sind sehr begeistert, dass diese fluorierten Moleküle so wirksame ‚Nachahmer‘ sind und dass wir in unserer Forschung diesen Translationspunkt erreicht haben. Ich denke, es unterstreicht die gesellschaftliche Relevanz interdisziplinärer Forschung an der Schnittstelle zwischen Chemie und Biologie.“
Um die Herstellung eines bivalenten Impfstoffs zu ermöglichen, fügten Doktorandin Patricia Priegue (MPI) das von der Serogruppe C (MenC) inspirierte, fluorierte Epitop mit einem äußeren Zellmembranprotein der Serogruppe B (MenB) zusammen. Das neu entworfene Molekül löste bei Mäusen die Bildung hochspezifischer Immunglobulin-G-(IgG-) Antikörper aus, Subtyp IgG1. „Die mit dieser Strategie erzeugten Antikörper schützten gegen Meningokokken B und C“, betont Peter Seeberger. Die Forscher validierten dies in vitro mit sogenannten SBA-Tests (Serum Bactericidal Antibody) und OPKA-Tests (Opsonophagocytic Killing Assay). „Das deutet darauf hin, dass diese fluorierten Glykokonjugate vielversprechende Leitstrukturen für Impfstoffe sind“, ergänzt der Potsdamer Experte.