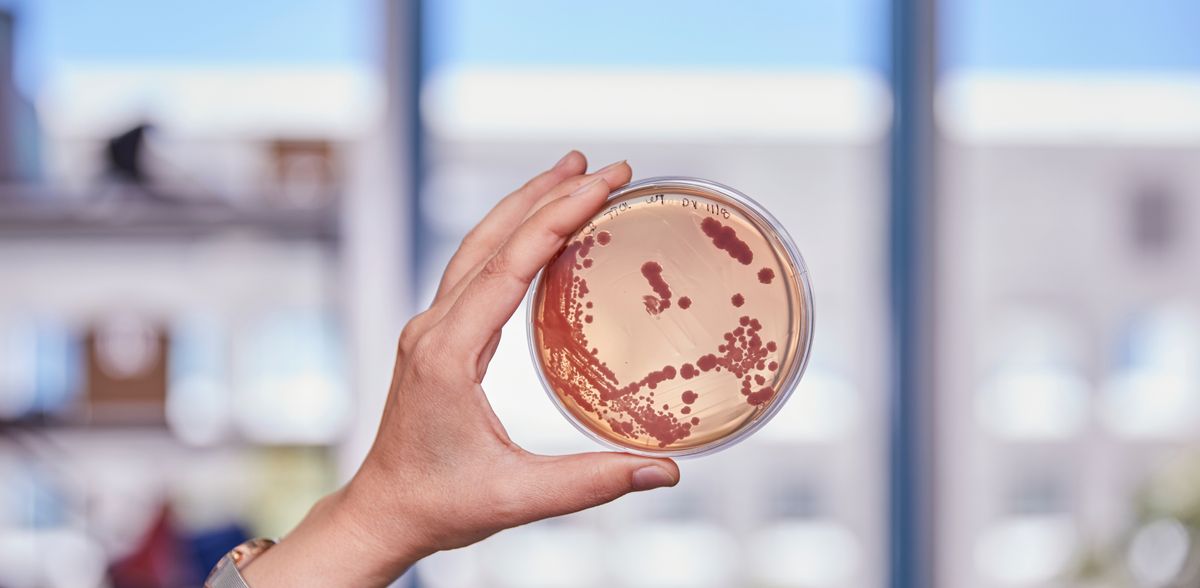
Ein neuer Weg zur Wirkstoffvielfalt
Viele wichtige Medikamente, wie Antibiotika und Krebsmedikamente, stammen von Naturstoffen aus Bakterien ab. Die bakteriellen Enzyme, die diese Wirkstoffe produzieren, gelten wegen ihres Baukastenprinzips als ideale Werkzeuge für die synthetische Biologie. Durch Erforschung der Protein-Evolution fand ein Team um Prof. Dr. Helge Bode „Fusionsstellen“ nach dem Vorbild der Natur, die eine schnellere und gezieltere Wirkstoffentwicklung ermöglichen.
Industrielle Produktion folgt meist dem Fließbandprinzip: Bauteile werden systematisch zu komplexen Produkten zusammengesetzt, wobei verschiedene Fertigungsstraßen unterschiedliche Produkte ergeben. Doch die eigentlichen Erfinder dieses Prinzips sind nicht Menschen, sondern Bakterien. Nicht-ribosomale Peptid-Synthetasen (NRPS) sind bakterielle Enzyme, die, ähnlich wie Fertigungsstraßen, eine immense Vielfalt an Naturstoffen hervorbringen. Dadurch können sich die Bakterien in der Natur in den unterschiedlichsten Lebensräumen behaupten. Wir Menschen verdanken den riesigen Enzymkomplexen viele wichtige Medikamente, wie Antibiotika.
Vielfalt der Enzymvarianten erzeugt Vielfalt der Naturstoffe
Die große Auswahl an Produkten entsteht dabei weniger durch die Menge an Bausteinen, sondern durch die Vielfalt der NRPS selbst, die sich aus der Kombination ihrer Enzym-Untereinheiten ergibt. Jede NRPS-Variante kann jeweils andere Bausteine binden, aktivieren und miteinander verknüpfen.
Das Team um Prof. Dr. Helge Bode am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg arbeitet daran, dieses Enzymsystem für die gezielte Wirkstoffproduktion im Labor zu nutzen. Dabei werden Teile der Enzyme und damit die funktionellen Eigenschaften ganzer Enzymkomplexe verändert (NRPS-Engineering), so dass Produkte mit neuen Eigenschaften entstehen.
Doch obwohl dieser Ansatz bereits seit einigen Jahren verfolgt wird, funktionierte er bisher noch nicht wie erhofft. „Wir sehen eine große Chance darin, von der Natur zu lernen. Wenn wir die natürlichen Prozesse verstehen, wissen wir, welche Bereiche des Enzyms sich am besten für das NRPS-Engineering eignen“, erklärt Dr. Kenan Bozhüyük, einer der Erstautoren der Studie, die im Wissenschaftsmagazin „Science“ erschien.
Rekombination nach dem Vorbild der Natur
Um herauszufinden, welche Untereinheiten des Enzyms besonders gut miteinander zusammenarbeiten, konzentrierte sich das Team auf die Frage: an welchen Positionen setzt die Evolution selbst an, um neue „Fliessbänder“ zusammenzubauen oder zu verändern, damit benötigte Wirkstoffe entstehen? Zusammen mit der Gruppe von Dr. Georg Hochberg (ebenfalls MPI) und Prof. Dr. Michael Groll (TU München) suchte das Team nach „Hotspots“ der natürlichen Rekombination. „Dazu haben wir mehrere zehntausend Enzyme bioinformatisch analysiert und die Analyse anschließend mit Laborexperimenten kombiniert, um die vorhergesagten Zielstellen zu überprüfen“, erklären die Erstautoren Leonard Präve und Dr. Carsten Kegler.
Tatsächlich fand das Team einen neuen „Fusionspunkt“ für die gezielte Herstellung funktionsfähiger NRPS-Hybride. Mit seiner Hilfe konnten schließlich sogar NRPS-Sequenzen aus völlig unterschiedlichen Organismen wie Bakterien und Pilzen miteinander kombiniert werden.
Ihr neues Wissen überprüften die Forschenden dann in einem medizinischen Zusammenhang: Sie konstruierten ein neues, pharmakologisch aktives Peptid. Die breit angelegte Studie zeigt das große Potenzial der bakteriellen Naturstoffe als Grundlage neuer Medikamente.
Das Ziel: Maßgeschneiderte Arzneimittel
„Im Bereich der synthetischen Biologie und der evolutionären Biochemie hat die Forschung in den letzten Jahren enorme Fortschritte gemacht,“ sagt Prof. Helge Bode, Direktor am Max-Planck-Institut in Marburg. „Der Vorteil unseres Ansatzes ist, dass wir evolutionäre Prozesse nutzen, die sich über Millionen von Jahren bewährt haben. Unsere von der Evolution inspirierten Fusionsstellen sind vielseitiger und haben höhere Erfolgsraten.“
Der Ansatz kombiniert die Synthetische Biologie mit Hochdurchsatzmethoden, die für das schnellere und damit kostengünstigere Auffinden biologisch aktiver Wirkstoffe notwendig sind. Damit wollen die Forschenden zukünftig maßgeschneiderte biologische Arzneimittel mit verbesserten therapeutischen Eigenschaften entwickeln – was angesichts der Zunahme an Arzneimittel-Resistenzen und Wirkstoff-Unverträglichkeiten immer wichtiger wird.
Originalveröffentlichung
Bozhüyük, K.A.J.; Präve, L.; Kegler, C.; Schenk, L.; Kaiser, S.; Schelhas, C.; Shi, Y.-N.; Kuttenlochner, W.; Schreiber, M.; Kandler, J.; Alanjary, M.; Mohiuddin, T.M.; Groll, M.; Hochberg, G. K. A.; Bode, H. B.; "Evolution inspired engineering of non-ribosomal peptide synthetases"; Science Vol. 383, 2024-
Meistgelesene News
Originalveröffentlichung
Bozhüyük, K.A.J.; Präve, L.; Kegler, C.; Schenk, L.; Kaiser, S.; Schelhas, C.; Shi, Y.-N.; Kuttenlochner, W.; Schreiber, M.; Kandler, J.; Alanjary, M.; Mohiuddin, T.M.; Groll, M.; Hochberg, G. K. A.; Bode, H. B.; "Evolution inspired engineering of non-ribosomal peptide synthetases"; Science Vol. 383, 2024-
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Pharmaceutical Substances von Thieme Verlag
Entdecken Sie industrielle Synthesewege für 2.600 APIs
Ihr Recherchetool für Synthesen, Patente und Anwendungen – Pharmaceutical Substances

KNAUER IJM NanoScaler von KNAUER
Effiziente Formulierung von Lipid-Nanopartikeln für RNA-basierte Therapien
Optimieren Sie die Wirkstoffverkapselung von 1 ml bis zu Hunderten von Millilitern mit minimalem Wirkstoffeinsatz

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Merck erwirbt Exelead und stärkt Angebot für die Auftragsentwicklung und -herstellung von mRNA - Gezielte Akquisition soll CDMO-Services für neue Modalitäten stärken
BASF Plant Science baut 2011 Amflora-Kartoffeln in Deutschland und Schweden an
Teloblastie

Vor die Welle kommen - Wie Forscher Krankheiten im Abwasser ablesen - In den USA entstehe bereits ein neuer Industriezweig: Start-ups bieten etwa Abwassermonitoring für Kommunen an
Eine halbe Nadel im Heuhaufen - Methode zur Spurenanalytik von niedermolekularen Verbindungen

QX600-Troepfchen-Digital-PCR-(ddPCR)-System

Genaktivität von Bakterien unter Rotlicht - Ergebnisse eröffnen spannende Möglichkeiten in der biotechnologischen Anwendung von Bakterien
Zulassungsantrag von Boehringer Ingelheim für Biosimilarkandidaten zu Humira akzeptiert - Boehringer Ingelheim erstmals einen Biosimilarkandidaten zum Zulassungsverfahren bei EMA und FDA ein

Oktoberfest-Abwasser wird auf Corona getestet: noch keine Wiesn-Welle - «Wir haben eine Inkubationszeit von fünf Tagen. Es ist nicht zu erwarten, dass man da jetzt schon große Sprünge sieht»

Jung-Stiftung für Wissenschaft und Forschung verleiht Jung-Preis für Medizin 2023 an Özlem Türeci - Stefan Rose-John erhält Preis für sein Lebenswerk, Achmed Mrestani wird als Nachwuchsforscher ausgezeichnet
Möglicher Milliardendeal: Novo Nordisk will Spin-off der MHH erwerben