Ausgeklügelter Mechanismus aufgedeckt: Zellen erben Schutz vor Sonnenbrand
Stressgranula bewahren Zellen vor den Folgen von UV-Strahlung
UV-Strahlung aus dem Sonnenlicht kann Sonnenbrand verursachen und das Risiko von Hautkrebs erhöhen, indem sie die DNA und RNA schädigt. Forschende am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg haben einen zellulären Schutzschild entdeckt, mit dem sich Zellen vor den negativen Folgen von UV-beschädigter RNA schützen können. Bei der Zellteilung geben Zellen ein Schutzsystem an ihre Tochterzellen weiter. Spezielle Stressgranula, die vom Enzym DHX9 gebildet werden, können beschädigte RNA identifizieren und einfangen, um die neu entstandenen Zellen nicht zu gefährden.
Mütter haben eine enge Bindung zu ihren Töchtern. Dies trifft auch auf Zellen zu: Bei der Teilung erben die Tochterzellen genetisches Material und andere Moleküle von ihren Mutterzellen. Dieses Erbe umfasst sowohl nützliche Komponenten als auch potenziell schädliche Mutationen oder beschädigte Moleküle.
Wie Tochterzellen die Auswirkungen eines schädlichen Erbes bewältigen, war bislang ein Rätsel. Eine Studie des Max-Planck-Instituts für Immunbiologie und Epigenetik in Freiburg hat nun einen ausgeklügelten Mechanismus aufgedeckt, mit dem sich die Tochterzellen vor UV-geschädigter RNA schützen, die von den Mutterzellen vererbt wurde.
Wenn die Sonnenstrahlen unsere Haut berühren, spenden sie Wärme und Vitalität. Doch hinter dieser sanften Umarmung verbirgt sich eine potenzielle Bedrohung: ultraviolette Strahlung (UV), der energiereichste Bestandteil des Sonnenlichts. Obwohl bekannt ist, dass UV-Strahlung die DNA schädigt und zu Hautkrebs führen kann, bleibt ihre Wirkung auf ein anderes lebenswichtiges Molekül, die RNA, oft unbemerkt.
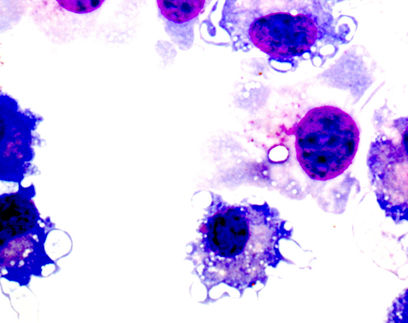
Während der Untersuchung der zellulären Reaktion auf verschiedene Stressfaktoren machten die Freiburger Forscherinnen und Forscher eine erstaunliche Entdeckung: Nach der UV-Bestrahlung sammelte sich ein Protein namens DHX9 in Tröpfchenstrukturen im Zytoplasma der Zelle an, sogenannten Granula. „DHX9 ist ein Enzym, das normalerweise im Zellkern vorkommt und RNA binden kann. Dass dieses Protein außerhalb des Zellkerns Tröpfchen bildet, hat uns wirklich sehr überrascht. Es ist fast so, als würde man einen riesigen Schneeball in der Wüste finden“, sagt Asifa Akhtar, Direktorin am Max-Planck-Institut für Immunbiologie und Epigenetik.
Das Geheimnis der DHX9-Stress-Granula
Da UV-Strahlung bekanntermaßen DNA-Schäden verursacht, vermutete das Team zunächst, dass die DHX9-Granula als Abwehrmechanismus gegen solche Schäden wirken. “Wir haben jedoch festgestellt, dass die DHX9-Granula nicht durch verschiedene Formen von DNA-Schäden ausgelöst werden. Das hat uns veranlasst, nach ihrem eigentlichen Auslöser zu suchen”, sagt Yilong Zhou, Erstautor der Studie. Dafür entwickelte das Team eine neuartige Extraktionsmethode, um die Tröpfchen direkt aus den Zellen zu isolieren und ihren Inhalt zu analysieren.
Bei der Analyse der DHX9-Stressgranula entdeckt das Team überraschenderweise, dass diese voller beschädigter RNA waren. „Die schädliche Auswirkung von UV-Licht auf RNA wird oft unterschätzt und von dessen Einfluss auf die DNA überschattet. Wir haben nun einen raffinierten Mechanismus aufgedeckt, durch den Zellen UV-geschädigte RNA mit Hilfe von DHX9-Granula aussondern und neutralisieren können“, erklärt Asifa Akhtar. Sobald Zellen eine durch UV-Strahlung induzierte Schädigung der RNA feststellen, isolieren sie rasch die beschädigten Moleküle in den DHX9-Granula, um zu verhindern, dass sich Schaden unkontrolliert in der Zelle ausbreitet und weiteres Chaos verursacht.
Schutzmechanismus in Tochterzellen
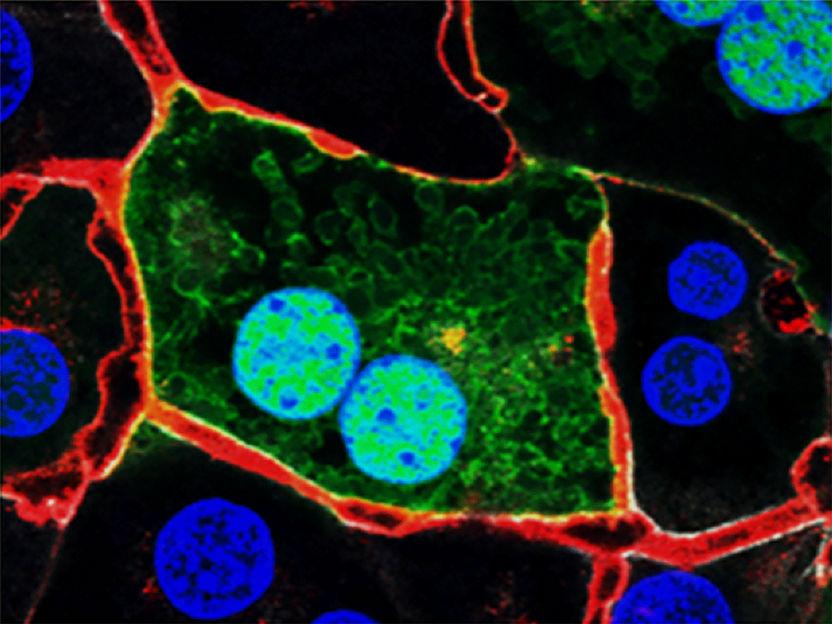
„Was uns aber noch mehr faszinierte, war die Entdeckung, dass Zellen mit DHX9-Granula immer paarweise auftraten. Dies deutete darauf hin, dass die Granula nicht in der ursprünglich durch UV-Licht beschädigten Mutterzelle entstehen, sondern erst in den daraus hervorgegangenen Tochterzellen gebildet werden“, erklärt Yilong Zhou. Mikroskopieaufnahmen von lebenden Zellen bestätigen diese Hypothese. „Man kann deutlich erkennen, wie DHX9 normalerweise im Kern der Zelle liegt, sich aber kurz nach der Zellteilung in Tröpfchenform im Zytoplasma der beiden neuen Tochterzellen ansammelt”, fügt Zhou hinzu.
Auffallend ist, dass das Verhindern der Bildung dieser DHX9-Granula in den Tochterzellen zu einem schnelleren Zelltod führt. Dies betont, wie wichtig es für die Tochterzellen ist, die beschädigte RNA ihrer Vorläuferzellen zu identifizieren und in DHX9-Granula einzulagern. „Dieser Prozess gleicht einem gezielten Neuanfang, der die Zelle darauf vorbereitet, ihre eigene Reise anzutreten, ohne den Ballast der vorherigen Generation mit sich herumzuschleppen“, sagt Asifa Akhtar.
Das Verständnis, wie Tochterzellen sich gegen von UV-induzierte Schäden an der RNA ihrer Elternzellen schützen, erweitert nicht nur unsere Kenntnisse über den Zellzyklus, sondern öffnet auch neue Wege in der medizinischen Forschung. Sonnenbrand oder neurodegenerative Erkrankungen und Krebs sind eng mit Störungen der RNA und Anomalien im Zellzyklus verbunden. „Wenn wir besser verstehen, wie eine neu entstandene Zelle beschädigte RNA gezielt erkennt und abbaut, könnte dies zu neuen Behandlungsmöglichkeiten für Krankheiten führen, die durch Fehler in der RNA-Verarbeitung oder eine gestörte Stressreaktion ausgelöst werden“, erklärt Asifa Akhtar.
Originalveröffentlichung
Yilong Zhou, Amol Panhale, Maria Shvedunova, Mirela Balan, Alejandro Gomez-Auli, Herbert Holz, Janine Seyfferth, Martin Helmstädter, Séverine Kayser, Yuling Zhao, Niyazi Umut Erdogdu, Iga Grzadzielewska, Gerhard Mittler, Thomas Manke, Asifa Akhtar; "RNA damage compartmentalization by DHX9 stress granules"; Cell