Nanotransporter mit Fluchtreflex
Tumorpezifische Wirkstoff-Freisetzung durch gesteuerten Endosomal Escape
Protein-basierte Wirkstoffe müssen so in Zellen eingeschleust werden, dass sie dort nicht gleich abgebaut werden. Ein neuer Ansatz soll dafür sorgen, dass sie ausschließlich in bestimmten Zellen intakt bleiben, etwa Krebszellen. Ein japanisches Forschungsteam stellt in der Zeitschrift Angewandte Chemie einen Nanotransporter mit der Fähigkeit zur „Flucht“ aus Endosomen vor, bevor deren Fracht dort zersetzt wird. Aktiviert wird diese Fluchtfähigkeit aber nur in Endosomen bestimmter Tumorzellen.
© Wiley-VCH
Die Aufnahme von Nanotransportern in Zellen erfolgt durch Endocytose: Treffen die Nanotransporter auf die Zelloberfläche, stülpt sich die Zellmembran ein und schnürt ein Bläschen ab, ein Endosom, das ins Zellinnere wandert. In seiner späten Phase verschmilzt das Endosom mit Lysosomen, die Enzyme enthalten, zu sogenannten Endolysosomen. Körpereigene sowie Fremdstoffe werden darin durch die Enzyme abgebaut. Ein proteinbasierter Wirkstoff kann seine Wirkung nur dann entfalten, wenn er rechtzeitig vor dem Abbau daraus „entkommt“. Dies wird als „Endosomal Escape“ bezeichnet. Bestimmte Nanotransporter können die endo/lysosomale Membran öffnen und haben damit eine Endosomal Escape-Fähigkeit.
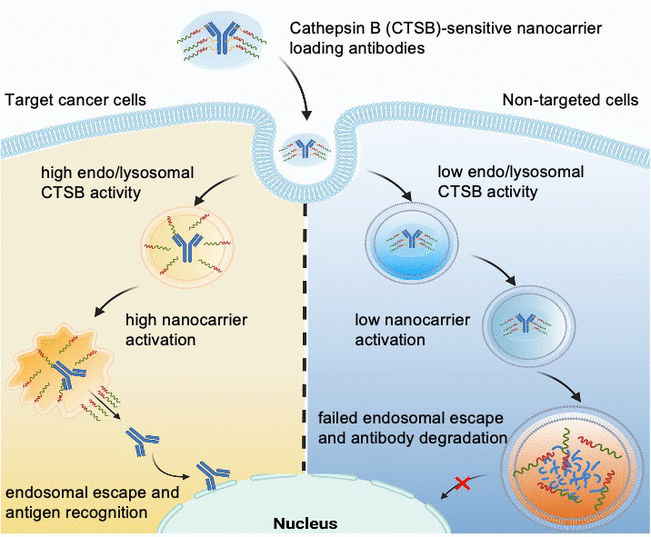
Das Team um Kazunori Kataoka und Horacio Cabral möchte einen Schritt weitergehen und Nanotransporter herstellen, bei denen der Endosomal Escape nur dann ausgelöst wird, wenn sie von ganz bestimmten Zellen, z.B. Tumorzellen, aufgenommen werden. Gesunde Zellen würden so geschont. Ausgenutzt werden sollte, dass sich verschiedene Zelltypen deutlich in der enzymatischen Aktivität ihrer Endolysosomen unterscheiden. So ist die Aktivität der Protease Cathepsin B (CTSB) in Endolysosomen bestimmter Krebszellen besonders hoch.
Mit speziellen fluoreszierenden Sonden-Moleküle untersuchte das Team von der Universität Tokio und dem Kawasaki Institute of Industrial Promotion zunächst die CTSB-Aktivität und den Proteinabbau in Endosomen. Sie stellten fest, dass in Krebszellen mit stark sauren Endosomen die Aktivität der CTSB bereits in deren früher Phase sehr hoch ist – deutlich früher als der Proteinabbau Fahrt aufnimmt. Dieses Zeitfenster gilt es zu nutzen: durch Nanotransporter, deren Endosomal Escape-Fähigkeit durch die CTSB der Krebszellen ausgelöst wird.
Das Team konstruierte Polyethylenglykol-basierte Nanotransporter mit Diaminoethan-Gruppen, die endo/lysosomale Membranen „aufreißen“ können. Über ein Verbindungsstück wurden daran Antikörper als Modell für einen Protein-Wirkstoff gebunden. Zunächst sind die „Reißwerkzeuge“ so abgeschirmt, dass sie noch inaktiv sind. Das Verbindungsstück wurde so konstruiert, dass es von der CTSB der Endolysosomen gespalten wird. Die Fracht wird vom Nanotransporter getrennt und die Reißwerkzeuge dabei aktiviert. Sie öffnen die endo/lysosomale Membran und setzen intakte Antikörper ins Zellinnere frei – aber nur in Tumorzellen mit erhöhter endosomaler CTSB-Aktivität.
Dieser Ansatz könnte eine neue Strategie für eine zellspezifische Freisetzung von Wirkstoffen durch reizempfindliche Nanotransporter mit kontrolliertem endosomalen Escape sein.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Pengwen Chen, Wenqian Yang, Yuki Mochida, Shangwei Li, Taehun Hong, Hiroaki Kinoh, Kazunori Kataoka, Horacio Cabral; "Selective Intracellular Delivery of Antibodies in Cancer Cells with Nanocarriers Sensing Endo/Lysosomal Enzymatic Activity"; Angewandte Chemie International Edition, 2024-2-27
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.