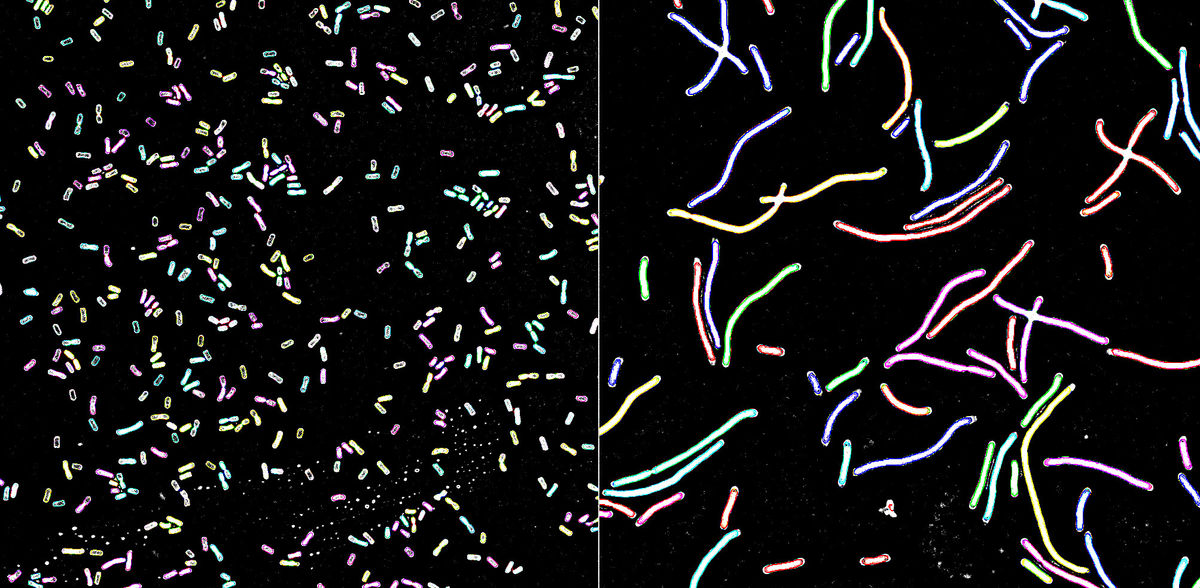Neuer Mechanismus zur Regulation der Zellteilung im bakteriellen Krankheitserreger Klebsiella aufgedeckt
Kleine Ribonukleinsäure mit großer Wirkung
Klebsiella pneumoniae ist einer der häufigsten und gefährlichsten bakteriellen Krankheitserreger, der im Menschen Infektionen des Magen-Darm-Traktes, Lungenentzündungen, Wundinfektionen bis hin zu Blutvergiftungen auslösen kann. Um Klebsiella in Zukunft besser begegnen zu können, hat ein Forschungsteam des Exzellenzclusters Balance of the Microverse der Universität Jena die Bakterien unter die molekularbiologische Lupe genommen: Dabei hat es die Bedeutung einer kleinen, nicht-kodierenden Ribonukleinsäure (kurz: sRNAs, vom Englischen: small ribonucleic acids) für die Genregulation von K. pneumoniae aufgedeckt. Über ihre Erkenntnisse berichten sie im Fachjournal „Proceedings of the National Academy of Sciences“.
„Klebsiella ist aus mehreren Gründen ein für die Forschung relevantes Bakterium. Zum einen ist dieser Keim in der Klinik problematisch, denn Klebsiella ist sehr anpassungsfähig, in der Lage sich schnell zu vermehren und neben den vorhandenen, natürlichen Resistenzen gegen verschiedene antibiotische Wirkstoffe auch kontinuierlich weitere Resistenzen zu erwerben. Zum anderen ist über die Genregulation in Klebsiella wenig bekannt, vor allem im Vergleich zu nah verwandten Spezies wie E. coli oder Salmonella“, sagt Dr. Kathrin Fröhlich, die Studienleiterin und Nachwuchsgruppenleiterin für RNA-Biologie der Bakterien an der Universität Jena. Gemeinsam mit einem Team aus Wissenschaftlern des Exzellenzclusters untersuchte sie das Transkriptom von Klebsiella auf der Suche nach bisher unbekannten sRNAs und Hinweisen auf deren Funktionen.
„Dabei haben wir neben vielen sRNAs, die bereits aus verwandten Bakterien bekannt waren auch über 50 neue potenzielle Regulatoren gefunden“, so der Erstautor der Studie Eric Ruhland, Doktorand am Jenaer Exzellenzcluster Balance of the Microverse. Die Interaktionspartner all dieser sRNAs ermittelten die Forschenden mittels einer auf Hochdurchsatz-Sequenzierung basierenden Methode.
Selber die Zellteilung unterbrechen
Bei der Untersuchung der so identifizierten RNA-Paarungen erweckte die sRNA DinR das besondere Interesse der Forschenden um Ruhland und Fröhlich. „Wir konnten schließlich herausfinden, dass DinR von der Zelle produziert wird, wenn DNA-Schäden auftreten. Unter dieser Bedingung hemmt DinR die Bildung von FtsZ, einem für die Zellteilung wichtigen Strukturprotein“, so Ruhland. DinR kontrolliert damit einen weiteren, bisher unbekannten Mechanismus, mit dem die Bakterien die Zellteilung unterbrechen können, falls Defekte am Erbgut vorhanden sind. Dies dient dazu, der Zelle Zeit zu verschaffen und das geschädigte Genom zu reparieren, bevor es an eine weitere Generation des Bakteriums weitergegeben wird – aus evolutionärer Sicht ein Mechanismus, der dazu dient, möglichst gesunde Nachkommen zu produzieren.
„Die Reparatur der DNA ist aber fehleranfällig und es kommt in dieser Stresssituation zu einer höheren Mutationsrate“, sagt Fröhlich. Diese Veränderungen des Erbgutes können mitunter zu neuen Antibiotikaresistenzen führen oder die Widerstandsfähigkeit der Bakterien verändern. „Wir möchten zukünftig verstehen, wie genau Klebsiella mit der DNA-Schädigung umgeht, und welche Rolle sRNAs für die vergleichsweise hohe Anpassungsfähigkeit der Bakterienspezies spielen, durch die Klebsiella vor allem im klinischen Bereich immer problematischer wird“, sagt die Nachwuchsgruppenleiterin. „Mit dieser Studie tragen wir zu einem besseren Verständnis für die grundlegenden molekularbiologischen Prozesse in Klebsiella bei, aus dem sich auch Wege eröffnen können, Infektionen gezielter zu behandeln.“
Originalveröffentlichung
Eric Ruhland, Malte Siemers, Ruman Gerst, Felix Späth, Laura Nicole Vogt, Marc Thilo Figge, Kai Papenfort, Kathrin Sophie Fröhlich; "The global RNA–RNA interactome of Klebsiella pneumoniae unveils a small RNA regulator of cell division"; Proceedings of the National Academy of Sciences, Volume 121, 2024-2-20