Neuer Ansatz für schnellen und kostengünstigen Nachweis von Krankheitserregern
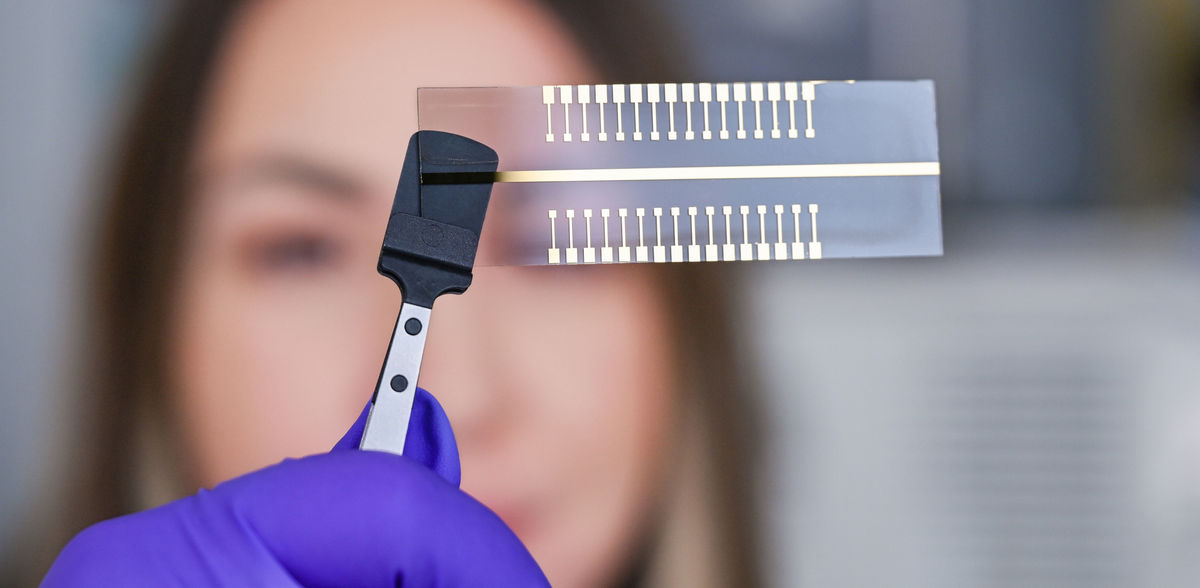
Handtellergroßes Testsystem kann bis zu 32 Analysen einer Probe gleichzeitig durchführen
Krankheiten frühzeitig zu erkennen oder sogar schon den Ausbruch vorhersagen zu können, wäre für Mediziner*innen und Patient*innen gleichermaßen von großem Vorteil. Ein Forschungsteam um Dr. Larysa Baraban am Helmholtz-Zentrum Dresden-Rossendorf (HZDR) entwickelt intelligente, miniaturisierte Biosensorgeräte und -systeme unter Verwendung von Nanomaterialien, um Biomoleküle und Zellen sowie biochemische Reaktionen oder Prozesse als Marker von Krankheiten bestimmen zu können. In einer aktuellen Veröffentlichung in Biosensors and Bioelectronics beschreibt das Team die Entwicklung eines portablen, handtellergroßen Testsystems, das bis zu 32 Analysen einer Probe gleichzeitig durchführen kann.
Es gibt verschiedene Möglichkeiten und Wirkmechanismen, um Krankheitserreger in Körperflüssigkeiten nachweisen zu können. Eine Variante, an der Baraban vom HZDR-Institut für Radiopharmazeutische Krebsforschung mit ihrem Team forscht, ist der Nachweis über Feldeffekttransistoren (FET) aus der Elektronik. Das Wirkprinzip ist einfach: Ein definierter elektrischer Strom fließt von A nach B. Dieser Strom kann durch das elektrische Potential an der Oberfläche eines Gates reguliert werden, das wie ein präzises, kontinuierliches Ventil wirkt. Krankheitsrelevante Biomoleküle binden sich an die Gate-Oberfläche und verändern so das elektrische Potential und damit auch die Stromstärke. Liegt keine signifikante Stromänderung vor, haben sich auch keine Biomoleküle an die Sensoroberfläche gebunden. Umgekehrt bedeutet eine Veränderung des Stroms, dass krankheitsbezogene Biomoleküle an der Sensoroberfläche zu finden sind. Diese Biosensoren können so gestaltet werden, dass sie spezifisch verschiedene Biomoleküle nachweisen. Unterschiedliche Krankheitserreger rufen unterschiedliche elektrische Potentiale und damit unterschiedliche Stromstärken hervor. Krebszellen verursachen also eine andere Stromstärke als beispielsweise ein Grippevirus.
Entwicklung wiederverwertbarer Transistoren
Nachteil dieser elektronischen FET-basierten Biosensoren ist, dass die Testflächen nicht wiederverwertbar sind und nach jeder Probe der gesamte Transistor entsorgt werden muss. Da es sich hierbei um kostenintensive Halbleitermaterialien handelt, ist dies teuer und umweltschädlich zugleich. Deshalb ging Baraban mit ihrer Abteilung Nano-Mikrosysteme für Biowissenschaften einen Schritt weiter und versuchte, die Potentialänderungen nicht direkt auf der Oberfläche des Transistors zu messen, sondern an einer separaten Elektrode, die mit dem Gate des Transistors verbunden ist. „Das gibt uns die Möglichkeit, den Transistor mehrfach zu nutzen. Wir separieren das Gate und sprechen von einem ‚Extended Gate‘ – also einer Erweiterung des Testsystems.“
Doch damit nicht genug: Das Team dachte noch weiter und stellte sich einer nächsten Herausforderung: „Wir möchten natürlich, dass dieses System auch mehrere Analysen gleichzeitig durchführen kann.“ Den Forschenden ist es gelungen, Extended Gates mit 32 Test-Pads zu entwickeln. Baraban erklärt: „Das bedeutet, dass eine Probe gleichzeitig auf jedem einzelnen der Pads bezüglich eines anderen Krankheitserregers getestet werden kann.“
Nachgewiesen haben die Wissenschaftler*innen die Funktionsweise zunächst an Interleukin-6 (IL-6), einem Molekül, das für die Kommunikation zwischen Immunzellen verantwortlich ist. „Egal, ob einfache Erkältung oder Krebserkrankung – die Konzentration von IL-6 ändert sich. Verschiedene Krankheiten und auch verschiedene Stadien einer Krankheit erzeugen unterschiedliche Bilder. Deshalb ist IL-6 sehr gut als Marker geeignet.“
Nanopartikel zur Steigerung der Sensitivität
Um die Methode noch sensitiver zu gestalten, nutzte das Team um Baraban zudem Nanostrukturen. Nanopartikel konzentrieren oder lokalisieren die Ladung, um das Spannungssignal zu verstärken. „Die Sensitivität der Tests ist signifikant höher, als wenn wir ohne Nanopartikel arbeiten.“ Da auf dem Markt inzwischen fertige Nanopartikel-Kits für die Forschung erhältlich sind, ist dieses Verfahren gut einsetzbar. Aktuell haben die HZDR-Wissenschaftler*innen mit Goldnanopartikeln gearbeitet. Künftig wollen sie auch andere Nanopartikel untersuchen. Im Ergebnis der aktuellen Forschungen ist ein funktionsfähiges, handliches Testsystem entstanden, bestehend aus einem Transistor und 32 Testpads, mit dem unterschiedliche Krankheisterreger in kürzester Zeit nachgewiesen werden können.
Mit dem beschriebenen Testsystem könnte künftig beispielsweise der Verlauf von Immuntherapien bei Krebspatient*innen kontrolliert werden. Eine weitere Möglichkeit wäre, schon zu Beginn einer Viruserkrankung wie Grippe oder COVID die Stärke der Krankheit und deren Verlauf vorherzusagen. Verglichen mit bereits existierenden Technologien ist das neue Testsystem kostengünstiger und schneller. Deshalb hoffen Baraban und ihr Team jetzt auf Interesse aus der Industrie.
Originalveröffentlichung
Željko Janićijević, Trang-Anh Nguyen-Le, Ahmed Alsadig, Isli Cela, Rugilė Žilėnaite, Taufhik Hossain Tonmoy, Manja Kubeil, Michael Bachmann, Larysa Baraban; "Methods gold standard in clinic millifluidics multiplexed extended gate field-effect transistor biosensor with gold nanoantennae as signal amplifiers"; Biosensors and Bioelectronics, Volume 241