Wie sich das Coronavirus gegen unser Immunsystem wehrt
Forschungsteam identifiziert „Schutzschalter“ in Protein des Virus SARS-CoV-2
Mit über 700 Millionen Erkrankten und fast sieben Millionen Toten war die weltweite Ausbreitung von Covid-19 die bislang verheerendste Pandemie des 21. Jahrhunderts. Impfstoffe und Medikamente gegen das Coronavirus SARS-CoV-2 konnten den Krankheitsverlauf bei vielen Menschen abschwächen und die Pandemie eindämmen. Die Gefahr weiterer Ausbrüche ist jedoch nicht gebannt: Das Virus verändert ständig seinen Bauplan. Dadurch kann es immer effektiver menschliche Zellen infizieren und sich vermehren. Zusätzlich entwickelt es im „molekularen Wettrüsten“ mit dem menschlichen Immunsystem vielfältige Strategien gegen die Abwehr. Ein Team unter der Leitung von Forschenden der Universität Göttingen hat nun im Coronavirus verschiedene „Schutzschalter“ entdeckt, die es vor Angriffen des Immunsystems bewahren. Die Ergebnisse wurden in der Fachzeitschrift Nature Communications veröffentlicht.
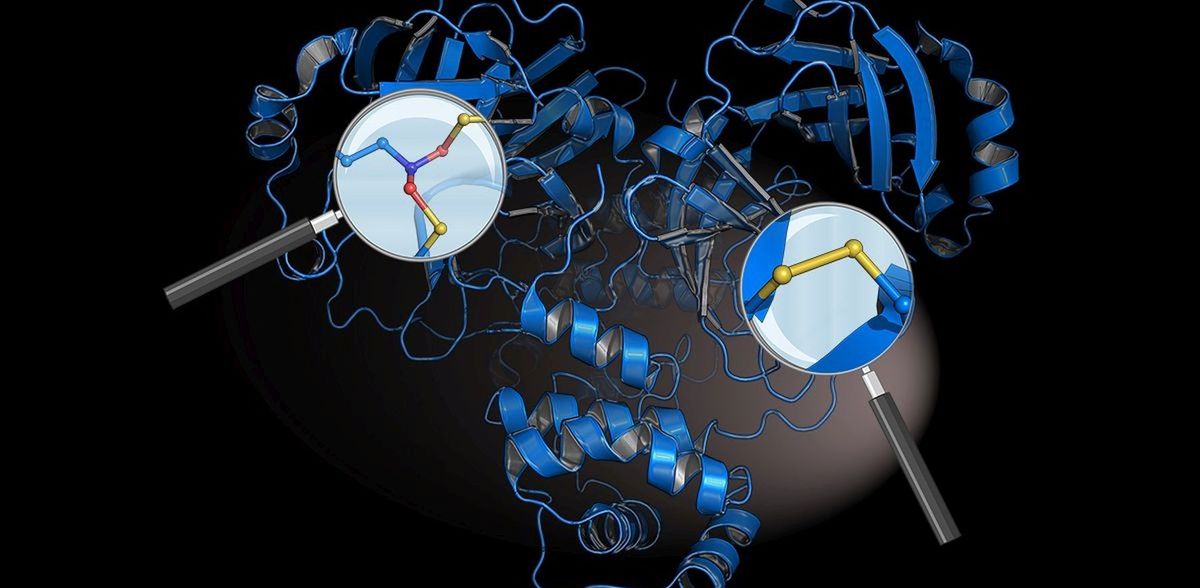
Die Forschenden wiesen zwei bisher unbekannte chemische „Schutzschalter“ bei einem der bedeutendsten Proteine des Coronavirus nach: der sogenannten Hauptprotease. Gegen dieses Protein richtet sich das wichtigste Medikament gegen Covid-19: Paxlovid®. Die Hauptprotease schneidet in infizierten Zellen andere Proteine des Virus frei und treibt so dessen Vermehrung voran. Dafür nutzt sie die Aminosäure Cystein. „Aus chemischer Sicht ist das eine Achillesferse des Coronavirus, denn Cystein kann durch hochreaktive Sauerstoffradikale, wie sie unser Immunsystem gegen das Virus einsetzt, zerstört werden“, erklärt Prof. Dr. Kai Tittmann aus der Abteilung Molekulare Enzymologie der Universität Göttingen, der die Studie geleitet und koordiniert hat.
Die „Schutzschalter“ wappnen die Hauptprotease gegen den „Radikalbeschuss“ des Immunsystems: Zum einen wird das Protein stabilisiert, indem jeweils ein Cystein mit einem benachbarten Cystein über zwei Schwefelatome ein Disulfid bildet. So wird das Cystein nicht zerstört. Zum anderen verbindet eine als SONOS bezeichnete Brücke zwischen Schwefelatomen (S), Sauerstoffatomen (O) und einem Stickstoffatom (N) drei Bereiche des Proteins und verhindert, dass Radikale dessen dreidimensionale Struktur beschädigen. Tittmann sagt: „Es ist faszinierend, wie chemisch elegant und effektiv sich das Coronavirus gegen das Immunsystem zur Wehr setzt. Das ursprüngliche Coronavirus SARS-CoV, das 2002/2003 eine Pandemie auslöste, besitzt diese Schutzschalter interessanterweise ebenfalls. Auch das zeigen wir erstmals.“
Mit der Entdeckung der „Schutzschalter“ stellten sich die Forschenden noch nicht zufrieden. Sie suchten mit dem chemischen Bauplan zur Hand nach Molekülen, die passgenau an die „Schutzschalter“ binden und die Hauptprotease hemmen. Solche Moleküle identifizierten sie nicht nur im Reagenzglas, sondern auch in infizierten Zellen. „Diese Art von Molekülen eröffnet neue therapeutische Möglichkeiten, um Coronaviren zu stoppen“, so Lisa-Marie Funk, Erstautorin der Studie und Mitarbeiterin der Abteilung Molekulare Enzymologie an der Universität Göttingen.
An der interdisziplinären Studie beteiligten sich Forschende der Fakultät für Biologie und Psychologie und der Fakultät für Chemie der Universität Göttingen, der Universitätsmedizin Göttingen, des Max-Planck-Instituts für Multidisziplinäre Naturwissenschaften, der Medizinischen Hochschule Hannover sowie der Universitäten Düsseldorf, Hamburg und Lübeck. Gefördert wurde die Studie vom Covid-19-Forschungsnetzwerk Niedersachsen (COFONI) und der Deutschen Forschungsgemeinschaft.
Originalveröffentlichung
Lisa-Marie Funk, Gereon Poschmann, Fabian Rabe von Pappenheim, Ashwin Chari, Kim M. Stegmann, Antje Dickmanns, Marie Wensien, Nora Eulig, Elham Paknia, Gabi Heyne, Elke Penka, Arwen R. Pearson, Carsten Berndt, Tobias Fritz, Sophia Bazzi, Jon Uranga, Ricardo A. Mata, Matthias Dobbelstein, Rolf Hilgenfeld, Ute Curth, Kai Tittmann; "Multiple redox switches of the SARS-CoV-2 main protease in vitro provide opportunities for drug design"; Nature Communications, Volume 15, 2024-1-9