„Tarnkappen-Effekt“: Medizinisch relevante Nanopartikel bewegen sich in Zellen schneller als erwartet
Entdeckung hat große Auswirkungen auf Anwendungen in der Nanomedizin wie die gezielte Abgabe von Wirkstoffen und intrazelluläre Studien
Ein Team von Forschenden von DESY und der Universität Hamburg hat in einem Experiment entdeckt, dass sich Gold-Nanopartikel schneller als erwartet durch flüssige biologische Materie bewegen können, wenn sie mit dem Polymer Polyethylenglykol (PEG) beschichtet sind. Die Daten des Teams, die mit Hilfe der Röntgenphotonen-Korrelationsspektroskopie gewonnen wurden, zeigen sowohl die Struktur als auch die Dynamik der Nanopartikel in verschiedenen biologischen Flüssigkeiten mit hoher zeitlicher Auflösung. Die Forschungsergebnisse wurden in der Zeitschrift „Aggregate“ veröffentlicht.
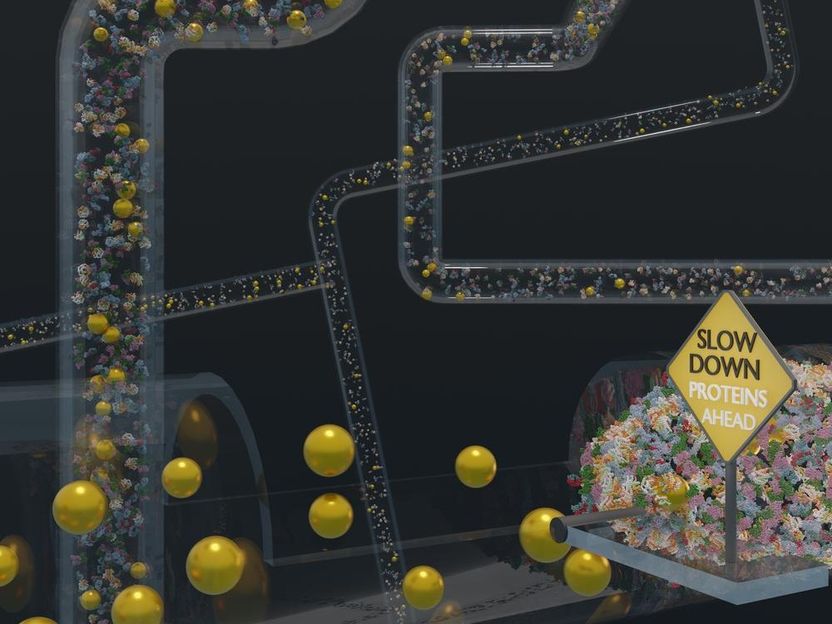
Zur Veranschaulichung der Art von Umgebungen, in denen Goldnanopartikel eingesetzt werden können, nähern sich die Nanopartikel dicht gepackten Bereichen von Proteinen. Die Forschenden, die hinter dieser Studie stehen, fanden heraus, dass die Nanopartikel, wenn sie mit dem Polymer PEG beschichtet sind, sich schnell durch solche dicht gepackten Umgebungen bewegen.
Ferdinand Otto, UHH
Im ständig wachsenden Bereich der Nanomedizin sind Gold-Nanopartikel zu einem vielversprechenden Werkzeug geworden. Bei den Nanopartikeln handelt es sich um winzige Goldkristalle, die von organischen Molekülen, den so genannten Liganden, umgeben sind. Die Beschichtung von Gold-Nanopartikeln mit solchen Liganden lässt sich genau steuern. Außerdem ist Gold ungiftig, und Gold-Nanopartikel haben nützliche physikalische Eigenschaften wie starke Absorption und Streuung von sichtbarem Licht und Röntgenstrahlen. Dies macht Gold-Nanopartikel sehr nützlich für medizinische Anwendungen. Bei der COVID-19-Pandemie fanden sie breite Anwendung als Hauptbestandteil von Selbsttests, die weltweit eingesetzt wurden. Sie haben außerdem ein großes Potenzial für die gezielte Verabreichung von Medikamenten, als Kontrastmittel für die Computertomographie und für hyperthermische Therapieansätze, um nur einige zu nennen. Als potenzielle Krebsbehandlung könnten sie beispielsweise in einen Tumor injiziert und dann mit einem Laser überhitzt werden, um die Krebszellen von innen heraus abzutöten.
Viele für medizinische Anwendungen zugelassene Nanopartikel, darunter die für die meisten COVID-Impfstoffe verwendeten Lipid-Nanopartikel, sind mit PEG beschichtet, um ihre Stabilität, Löslichkeit und Verteilung im Körper zu verbessern. Es ist daher von großer Bedeutung zu verstehen, wie die Dynamik der Partikel in biologischen Flüssigkeiten durch dieses Polymer beeinflusst wird. Aufgrund ihrer winzigen Größe können die Nanopartikel sogar in die Zielzellen eindringen, und zwar in der Regel dann, wenn sie von einem Klumpen von Proteinen umgeben sind, die im Blut in hohen Konzentrationen und im Zellinneren in noch höherer Dichte vorhanden sind. Die Verklumpung der Proteine verändert nicht nur die Eigenschaften der Nanopartikel, so dass sie ihr Ziel möglicherweise nicht mehr erreichen, sondern kann auch eine unerwünschte Immunreaktion auslösen. PEG-Beschichtungen können diese unerwünschte Proteinadsorption stark reduzieren, und Wissenschaftler:innen sprechen oft von einem „Tarnkappen-Effekt“, den die PEG-Beschichtung bietet.
In ihrer Studie verwendete das Team Gold-Nanopartikel mit maßgeschneiderten PEG-Beschichtungen und untersuchte deren Dynamik in Gegenwart unterschiedlicher Proteinkonzentrationen. Auf diese Weise konnten sie die verschiedenen Umgebungen nachahmen, denen Nanopartikel im Körper begegnen: vom Blutkreislauf bis zum Inneren von Zellen mit extrem hohen Proteinkonzentrationen.
„Je mehr Moleküle man in die Flüssigkeit gibt und je dichter sie ist, desto mehr nähert man sich der so genannten Proteinverdichtung, die im Körper stattfindet“, sagt DESY-Wissenschaftler Felix Lehmkühler, der die Forschung mit geleitet hat. Lehmkühler vergleicht die Proteinverdichtung mit einer großen Party in einem kleinen Raum: Die Partygäste stehen alle dicht beieinander, und jemand – in diesem Fall das Gold-Nanopartikel –, der versucht, hindurchzukommen, muss ständig die Richtung ändern oder wird auf dem Weg von einigen der Partygäste aufgehalten.
„Frühere Experimente haben immer wieder gezeigt, dass dieser Proteinadsorptionsprozess ein üblicher Effekt ist. Wir wollten mit unserem Experiment an die Grenzen des Möglichen gehen: eine hohe Proteinkonzentration erreichen, wie sie im wirklichen Leben vorkommt, und die Auswirkungen einer PEG-Hülle testen“, sagt Florian Schulz, Postdoc an der Universität Hamburg, der das Experiment gemeinsam mit Lehmkühler leitete. „Wir hätten erwartet, dass die Nanopartikel langsamer werden, sobald sie in eine proteinreiche Umgebung gelangen.“
Das Team fand jedoch etwas ganz anderes in seinen Ergebnissen. „Wenn wir in diese Situation einer Überfüllung mit Proteinen kommen, stellen wir fest, dass sich das Teilchen schneller bewegt als erwartet“, sagt Lehmkühler. Es scheint, als ob das Nanopartikel die Party in der vorherigen Analogie schnell durchschreiten würde. Das Team verwendete Röntgenphotonen-Korrelationsspektroskopie, um die Diffusion der Nanopartikel zu verfolgen. Sie beobachteten keine Anzeichen für die Adsorption von Proteinen an den Nanopartikeln, während sie sich fortbewegen, und bestätigten damit den vorteilhaften „Tarnkappen-Effekt“ der PEG-Beschichtungen.
In sehr dicht besiedelten Proteinumgebungen, ähnlich der Situation in Zellen, diffundieren die Nanopartikel viel schneller, als es die von der Theorie vorhergesagte Viskosität erlauben würde. Noch faszinierender ist, dass das Team feststellte, dass die Viskositäten der proteinreichen biologischen Lösungen selbst genau den Erwartungen entsprechen, wenn sie mit klassischen Methoden gemessen werden. Demzufolge unterscheidet sich die lokale Viskosität des Nanopartikels stark von der Viskosität des biologischen Materials im Ganzen - was bedeutet, dass das Nanopartikel einen starken Einfluss auf seine Umgebung hat, der diese schnelle Bewegung ermöglicht. Dies ist eine wichtige Erkenntnis für das Verständnis der Dynamik von Nanopartikeln in biologischen Systemen, die für ihre sichere und erfolgreiche Anwendung entscheidend ist.
„Die nanoskaligen Viskositätsänderungen waren eine Überraschung“, sagt Schulz. „Es ist das erste Mal, dass dieses Phänomen beobachtet wurde. Wir mussten es immer wieder überprüfen, um sicherzugehen, dass dieser Effekt auch echt ist. Das ist ein wirklich wichtiger Befund, denn er sagt uns, dass diese Nanopartikel so schnell diffundieren, weil sie ihre lokale Umgebung stark beeinflussen.“
„Diese Studie unterstreicht, wie wichtig diese gründlichen Messungen von Struktur und Dynamik für unser Verständnis komplexer Systeme sind“, sagt Universität Hamburg-Doktorand Ferdinand Otto, der Erstautor der Publikation, „und die Röntgenphotonen-Korrelationsspektroskopie ist eine hervorragende Methode, die in diesem Zusammenhang gerade erst am Anfang ihrer Möglichkeiten steht.“
Das Experiment wurde an der Europäischen Synchrotronquelle ESRF in Grenoble, Frankreich, durchgeführt. Diese Art der Forschung wird in Zukunft jedoch in hohem Maße von der geplanten Lichtquelle PETRA IV bei DESY profitieren. Die in dieser Forschung verwendete Technik, die Röntgenphotonen-Korrelationsspektroskopie, wird besonders von der Aufrüstung der heutigen PETRA III-Anlage profitieren, da die Brillanz von PETRA IV eine Erweiterung der zugänglichen Zeitskala auf Nanosekunden ermöglichen wird – dem Milliardstel einer Sekunde.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!