Kleines Protein, große Wirkung
Ein kleines Protein dient Bakterien als sensibles Alarmsystem, das sie vor antimikrobiellen Abwehrstoffen warnt
Die Natur nutzt antimikrobielle Peptide als Breitbandantibiotika: Sie bilden die erste Verteidigungslinie gegen eindringende Krankheitserreger. Bakterien wiederum haben Möglichkeiten entwickelt, diese Abwehr zu umgehen. Mikrobiologinnen und Mikrobiologen am Max-Planck-Institut in Marburg haben entdeckt, wie ein kleines Protein Bakterien in die Lage versetzt, antimikrobielle Peptide frühzeitig zu erkennen und sich effektiv zu verteidigen. Ihre Studie liefert eine molekulare Grundlage für die Entwicklung neuer Peptid-basierter Wirkstoffe.
Kleine Proteine sind in der Regel weniger als 50 Aminosäuren lang. Aufgrund ihrer geringen Größe wurden sie in der Vergangenheit oft übersehen. Fortschritte in der Bioinformatik und die Erstellung von Ribosomenprofilen haben gezeigt, dass Bakterien, Archaeen, Eukaryoten und mikrobielle Gemeinschaften Hunderte bis Tausende solcher kleinen Proteine produzieren. Studien zufolge regulieren sie vor allem verschiedene biologische Prozesse und Stoffwechselwege.
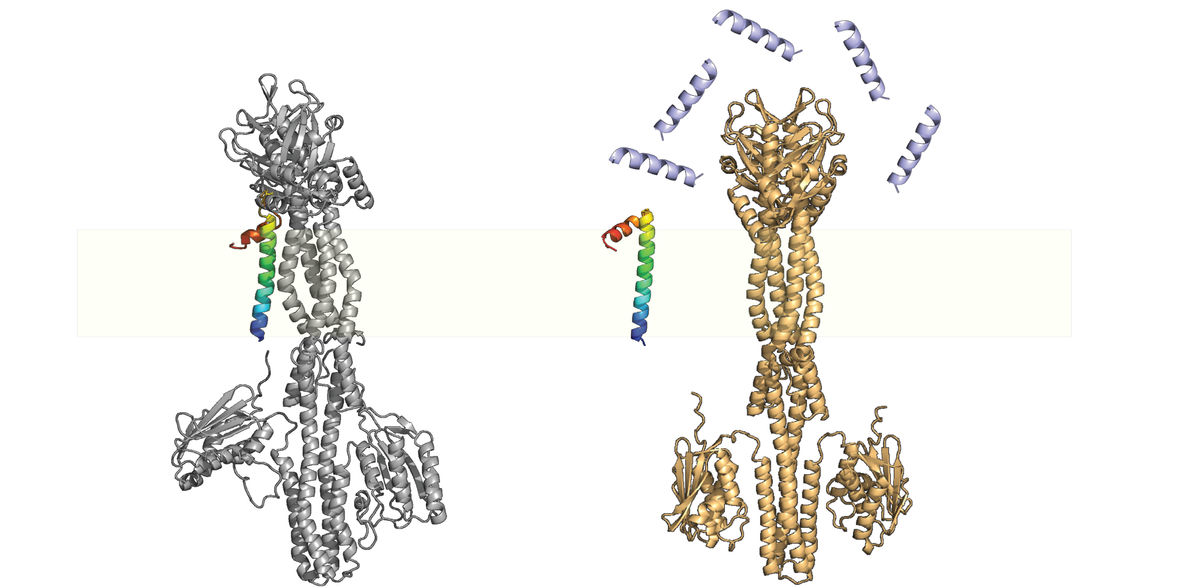
Projektgruppenleiterin Dr. Jing Yuan vom Max-Planck-Institute für terrestrische Mikrobiologie bezeichnet die kleinen Proteine als "Gadgets der Natur“. Ihr Team erforscht unter anderem ein wichtiges kleines Protein namens MgrB. Es ist in Enterobakterien weit verbreitet und wechselwirkt mit einer Sensorkinase namens PhoQ.
Die Sensorkinase ist ein membrangebundenes Protein, das wirtsspezifische Umweltreize wie Magnesiumkonzentration, niedrigen pH-Wert, erhöhte Osmolarität, langkettige ungesättigte Fettsäuren aus der Gallenflüssigkeit und antimikrobielle Peptide erkennt. Mit einem gut funktionierenden PhoQ/PhoP-System können pathogene Bakterien ihr Virulenzprogramm aktivieren und das Immunsystem des Säugetierwirtes zur richtigen Zeit am richtigen Ort umgehen. Das Zweikomponentensystem PhoQ/PhoP ist somit ein Hauptregulator des Virulenzprogramms, und seine Interaktion mit MgrB beeinflusst die bakterielle Virulenz und Resistenz gegenüber Medikamenten. Aber wie genau geschieht dies?
Wenn Bakterien in den Wirt eindringen, wird das PhoQ/PhoP-System aufgrund der relativ niedrigen physiologischen Magnesiumkonzentration aktiviert. Dies induziert dann die Expression von mgrB, was zu einer teilweisen Unterdrückung des PhoQ/PhoP-Systems führt. In Gegenwart von antimikrobiellen Peptiden (z.B. in der Darmschleimhaut oder in Makrophagen) löst sich MgrB wieder von PhoQ, hebt die hemmende Wirkung auf und löst die vollständige Aktivierung des Signalweges aus.
Das Forscherteam um Jing Yuan hat nun zusammen mit Kollegen der Universität Bern gezeigt, dass MgrB das Frühwarnsystem durch eine negative Rückkopplung stabilisiert. Ohne MgrB ist das PhoQ/PhoP-System hyperaktiv und reagiert nicht mehr auf geringe Mengen antimikrobieller Peptide.
"Es ist, als ob jemand im Dunkeln die Fäuste schwingt, ohne zu wissen, ob die Situation gefährlich ist oder nicht", erklärt die Forscherin. "Unsere Ergebnisse zeigen, wie wichtig ein so kleines Protein für die bakterielle Fitness und die Resistenz gegen Medikamente sein kann. Und sie liefern die molekulare Grundlage für die Entwicklung neuartiger Peptidregulatoren zur Kontrolle der bakteriellen Virulenz."
Indem sie die Eigenschaften von MgrB verändern, entwickelt Jing Yuans Gruppe derzeit neuartige Peptidregulatoren, die sie Super-MgrBs nennen. Super-MgrBs sollen dauerhaft an PhoQ binden und es dadurch hemmen. Dies würde das PhoQ/PhoP-System vollständig unterdrücken und das bakterielle Abwehrprogramm in einem ausgeschalteten Zustand halten. Die Forschenden gehen davon aus, dass Super-MgrBs die Erkennung antimikrobieller Peptide verhindern und damit krankheitserregende Bakterien angreifbarer machen könnten.