Neue Studie zur genetischen Magnetisierung lebender Bakterien
Große Potenziale für die Biomedizin
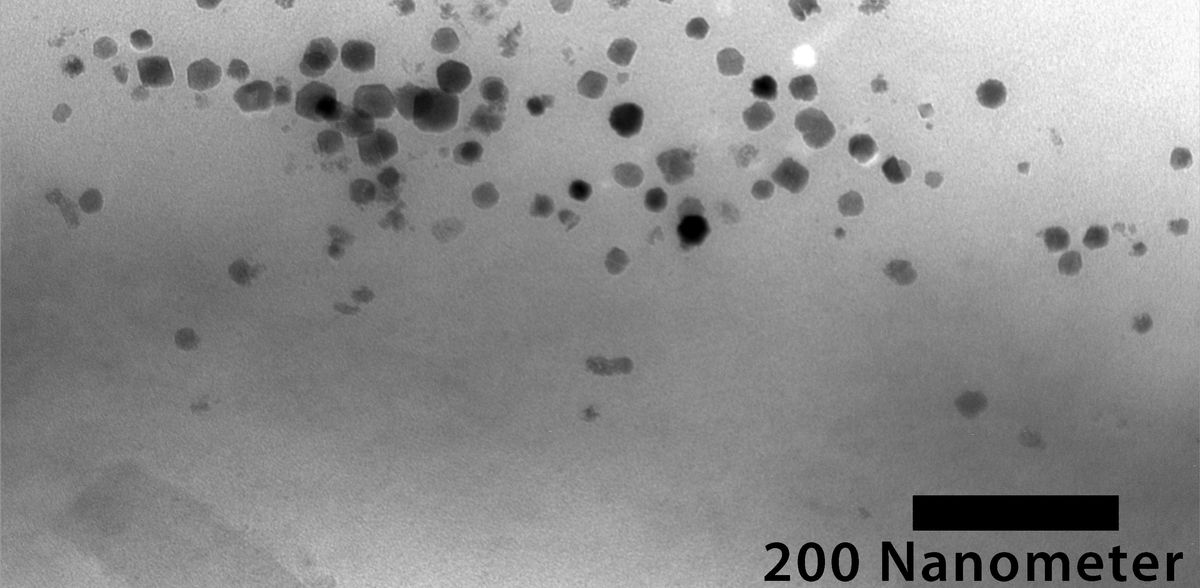
Magnetische Bakterien besitzen Fähigkeiten aufgrund der in ihrem Zellinneren verketteten magnetischen Nanopartikel, den Magnetosomen. Ein Forschungsteam an der Universität Bayreuth hat alle ca. 30 Gene, die für die Herstellung dieser Partikel zuständig sind, jetzt in einer breit angelegten Versuchsreihe auf nichtmagnetische Bakterien übertragen. Dabei entstanden Bakterienstämme, die nun ihrerseits Magnetosomen produzieren können. Die in „Nature Nanotechnology“ vorgestellten Forschungsergebnisse sind wegweisend für die Erzeugung magnetisierter lebender Zellen, die ein großes Potenzial für die Entwicklung innovativer diagnostischer und therapeutischer Methoden in der Biomedizin haben.
Die Forscher*innen haben aufgrund umfangreicher Untersuchungen zunächst 25 Arten von nichtmagnetischen Proteobakterien – der weitaus umfangreichsten Domäne von Bakterien – identifiziert, die sich besonders gut für den Gentransfer und für die Erforschung der Magnetosomenbildung eignen. Ausschlaggebend waren dabei sowohl biochemische Eigenschaften als auch die Verfügbarkeit spezieller Gensequenzen. Bei sieben Arten gelang die Magnetisierung: Diese Bakterien produzieren kontinuierlich Magnetosomen, in denen eisenhaltige Magnetitkristalle auf eine ähnliche Weise miteinander verkettet sind wie im „Spender“-Bakterium Magnetospirillum gryphiswaldense.
„Im Hinblick auf künftige Anwendungen in der Biomedizin ist es besonders vielversprechend, dass zwei Bakterienarten, die wir erfolgreich gentechnisch verändert haben, schon heute in der Biotechnologie weit verbreitet sind. Dem aktuellen Forschungsstand zufolge sind sie mit menschlichen Zellen gut verträglich. Dies eröffnet neue Perspektiven für eine Vielzahl biomedizinischer Anwendungen – beispielsweise für einen durch Mikroroboter gesteuerten Transport pharmazeutischer Wirkstoffe, für magnetische Bildgebungsverfahren oder sogar für Optimierungen der Hyperthermie-Krebstherapie“, sagt die Bayreuther Erstautorin der neuen Studie, Dr. Marina Dziuba, die als wissenschaftliche Mitarbeiterin am Lehrstuhl für Mikrobiologie forscht.
Die Bayreuther Forscher*innen haben die Magnetosomen, die von den neuen transgenen Bakterienstämmen produziert werden, genauer untersucht und so eine Reihe von Faktoren identifiziert, die an der Magnetosomenbildung ursächlich beteiligt sein könnten. Auch der Vergleich zwischen dem Genom dieser Stämme und dem Genom derjenigen gentechnisch veränderten Bakterien, die keine Magnetosomen produzieren konnten, hat zu wertvollen Erkenntnissen geführt. Vieles deutet darauf hin, dass die Magnetosomenbildung transgener Bakterienstämme in einem engen Zusammenhang mit ihrer Fähigkeit zur Photosynthese oder zu sauerstoffunabhängigen, sogenannten anaeroben Atmungsprozessen steht. Insgesamt zeigt die neue Studie, dass es nicht einzelne oder wenige besondere Gene sind, die den transgenenen Bakterien fehlen, wenn sie zur Magnetosomenbildung unfähig sind. Entscheidend dafür, dass sie nach dem Empfang der fremden Gencluster Magnetosomen synthetisieren, sind vielmehr eine Kombination bestimmter Stoffwechseleigenschaften sowie die Fähigkeit, die Erbinformation der fremden Gene effizient zur Herstellung zelleigener Proteine zu nutzen.
„Unsere Studie zeigt, dass weitere Forschungsarbeiten erforderlich sind, um die Biosynthese von Magnetosomen im Detail zu verstehen, Barrieren für deren Übertragung zu identifizieren und Strategien zu deren Überwindung zu entwickeln. Zugleich aber werfen unsere Ergebnisse ein neues Licht auf Stoffwechselprozesse, die die Magnetosomenbildung unterstützen. Sie bieten deshalb einen Rahmen für künftige Untersuchungen auf dem Weg zum Design neuer Stämme von biokompatiblen Magnetbakterien, die für biomedizinische und biotechnologische Innovationen maßgeschneidert sind“, erklärt Prof. Dr. Dirk Schüler, Inhaber des Lehrstuhls für Mikrobiologie an der Universität Bayreuth.
Bereits in früheren Forschungsarbeiten war es dem Bayreuther Team gelungen, die für die Magnetosomenbildung zuständigen Gene aus dem Bakterium Magnetospirillum gryphiswaldense – einem Modellorganismus der Forschung – in das Genom nichtmagnetischer Bakterien einzuschleusen. Doch nur in wenigen Fällen führte dieser Gentransfer dazu, dass gentechnisch veränderte Bakterien ihrerseits begannen, Magnetosomen zu bilden. Auch war es völlig unklar, von welchen Faktoren es möglicherweise abhängt, ob transgene Bakterien Magnetosomen herstellen. Vor diesem Hintergrund setzt die jetzt veröffentlichte Studie, an der auch ein Forschungspartner an der University of Pannonia in Veszprém/Ungarn mitgewirkt hat, wichtige neue Impulse für eine gezielte Magnetisierung lebender Zellen.