Wenn runzlige Falten gut sind: Schrumpelig aussehende Bakterien sind am besten an ihren Wirtsorganismus angepasst
Alle vielzelligen Lebewesen - von den einfachsten tierischen und pflanzlichen Organismen bis hin zum Menschen - leben in enger Verbindung mit einer Vielzahl von Mikroorganismen, die sich auf und in ihren Geweben ansiedeln und symbiotische Beziehungen mit dem Wirt eingehen. Viele Lebensfunktionen wie die Nährstoffaufnahme, die Regulierung des Immunsystems oder sogar neurologische Prozesse resultieren aus den Wechselwirkungen zwischen Wirtsorganismus und mikrobiellen Symbionten. Die funktionelle Zusammenarbeit zwischen Wirt und Mikroorganismen, die Wissenschaftlerinnen und Wissenschaftler als einen Metaorganismus bezeichnen, wird an der Christian-Albrechts-Universität zu Kiel (CAU) im Sonderforschungsbereich (SFB) 1182 „Entstehen und Funktionieren von Metaorganismen" im Detail untersucht.

Dr. Nancy Obeng und ihre Kolleginnen und Kollegen konnten in der neuen Studie mehrere konkrete Genmutationen identifizieren, die ursächlich mit der Wirtsanpassung des Bakteriums Pseudomonas lurida zusammenhängen.
© Christian Urban, Uni Kiel
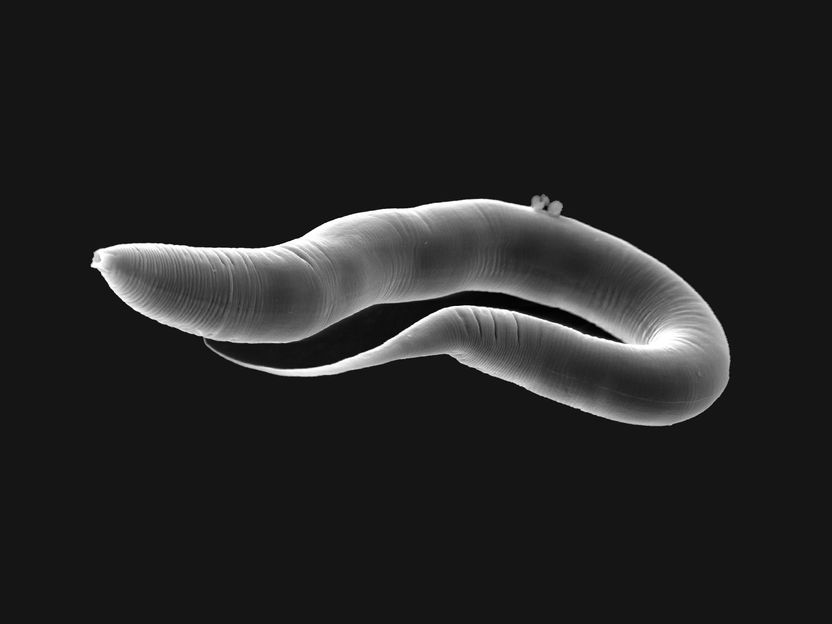
Das Forschungsteam untersuchte die Anpassung des Bakteriums P. lurida am Übergang von einer freilebenden zu einer wirtsgebundenen Lebensweise als Symbiont des Fadenwurms Caenorhabditis elegans (im Bild).
© Prof. Hinrich Schulenburg

Symbiotische Beziehungen von Mikroben und komplexeren Organismen sind so alt wie das vielzellige Leben selbst. Eine gängige Annahme über den Ursprung dieser Verflechtungen ist, dass sie primär auf einem evolutionären Vorteil für den Wirt beruhen. Diesem Paradigma steht entgegen, dass Mikroorganismen viel schneller evolvieren als ihre Wirte und ihre rasche Anpassungsfähigkeit möglicherweise ein wichtiger Treiber von Symbiosen sein kann.
Ein Forschungsteam aus der Arbeitsgruppe Evolutionsökologie und Genetik am Zoologischen Institut der CAU hat nun mittels sogenannter experimenteller Evolution wie auch genetischer Analysen untersucht, welche zellulären Mechanismen der Bakterien einer Anpassung an den Wirt zugrunde liegen und welche ökologischen Vorteile für die Mikroorganismen durch das Eingehen einer symbiotischen Beziehung entstehen können. Dazu untersuchten sie beispielhaft die Anpassung des Bakteriums Pseudomonas lurida am Übergang von einer freilebenden zu einer wirtsgebundenen Lebensweise als Symbiont des Fadenwurms Caenorhabditis elegans. Die Forschenden konnten mehrere konkrete Genmutationen identifizieren, die ursächlich mit der Wirtsanpassung der Bakterien zusammenhängen. Zusätzlich konnten sie experimentell bestätigen, dass diese Genveränderungen zu einem runzlig-faltigen Aussehen von Bakterienkolonien führen, was gleichzeitig eine sesshaftere, weniger mobile Lebensweise der Bakterien bewirkt und ihnen Wettbewerbsvorteile gegenüber nicht-wirtsangepassten Artgenossen verschafft. Ihre Ergebnisse veröffentlichten die Kieler Wissenschaftlerinnen und Wissenschaftler in der Fachzeitschrift Nature Microbiology.
Symbiose als vorteilhafte Strategie für das Bakterium
Um die Mechanismen der Wirtsanpassung in Bakterienzellen experimentell zu untersuchen, wählte das Forschungsteam das Bakterium P. lurida. Es kommt in der natürlichen Mikrobenbesiedlung von Fadenwürmern vor, kann aber auch freilebend ohne Wirtsorganismus existieren. Die Forschenden führten Versuchsreihen durch, in denen frei auf Agarplatten lebende P. lurida-Bakterien auf C. elegans trafen und sie für die Dauer einer Wurmgeneration mit den Wirten assoziieren konnten. Anschließend übertrugen sie diejenigen Bakterien, die sich in den Würmern angesiedelt hatten, wieder auf Platten, um erneut die Möglichkeit der Wirtsassoziation anzubieten. Diesen Zyklus wiederholten sie über zehn Generationen des Wurms, um den Bakterien eine Anpassung an das Wirtslebewesen zu ermöglichen.
„Auf diese Weise konnten die Bakterien evolvieren und dauerhafte Anpassungen an eine wirtsgebundene Lebensweise ausbilden“, erklärt die Erstautorin der Arbeit, Dr. Nancy Obeng, wissenschaftliche Mitarbeiterin in der Arbeitsgruppe Evolutionsökologie und Genetik. „Diese Anpassungen zeigten sich zunächst darin, dass die wirtsangepassten Bakterien einen runzlig-faltigen Kolonietyp auf dem Nährmedium ausbildeten“, so Obeng weiter. Dieser im Englischen als „Wrinkly“ bezeichnete Phänotyp trat sehr zahlreich auf, was auf seine Dominanz gegenüber anderen Typen hindeutet. Zusätzlich zeigte sich eine Reihe von funktionellen Unterschieden dieser evolvierten Bakterien: Sie konnten das Wirtslebewesen schneller besiedeln und besser dort verbleiben, aber auch effizient wieder in einen freilebenden Lebenszyklus zurückwechseln. Außerdem wiesen sie eine geringere Motilität auf, also eine weniger ausgeprägte Fähigkeit, sich im freilebenden Lebenszyklus zum Beispiel auf einem Nährmedium fortzubewegen. „Die Summe dieser Wirtsanpassungen stellt eine für das Bakterium vorteilhafte ökologische Strategie dar, die es den Wirtsspezialisten erlaubt, mehrere Wirte nacheinander erfolgreich zu besiedeln und sich insgesamt gegen das ursprüngliche Bakterium durchzusetzen“, sagt SFB 1182-Mitglied Obeng.
Genetischer Schalter steuert Anpassungen an das Wirtslebewesen
Die Forschenden gingen als nächstes der Frage nach, ob die beobachteten Anpassungen auf genetische Evolution zurückzuführen sind und wenn ja, welche Veränderung im Erbgut dafür verantwortlich sind. Dazu führten sie Genomsequenzierung der unterschiedlich angepassten Morphotypen des Bakteriums durch und verglichen sie mit dem Ursprungstypen. „Tatsächlich konnten wir bestimmte Gene identifizieren, die nur in den wirtsangepassten Bakterien mutiert waren. Zwei dieser Gene hängen mit dem sogenannten Wsp-System der Bakterienzellen zusammen, einer sensorischen Einrichtung, die Umgebungsveränderungen wahrnehmen und an Signaltransduktionswege innerhalb der Zelle weitergeben kann“, erklärt Obeng. „Die Mutation dieser Gene sorgt bei dem wirtsangepassten Bakterium dafür, dass ein bestimmter zellulärer Botenstoff, das sogenannte c-di-GMP, hochreguliert wird“, betont Obeng.
Um einen kausalen Zusammenhang dieses Systems mit der Anpassung an die Lebensweise im Wirt zu überprüfen, manipulierten die Forschenden die betreffenden Gene in einer nicht-wirtsangepassten Vergleichsgruppe von P. lurida. Auch diese Bakterien zeigten in der Folge die phänotypischen und funktionellen Anpassungen der Wirtsassoziation. Daneben zeigte der Vergleich mit anderen wirtslebenden Pseudomonas-Arten, dass bei ihnen ebenfalls die charakteristischen Genveränderungen zu finden waren. „Damit konnten wir c-di-GMP als regulatorischen Schalter für Etablierung einer Wirts-Assoziation identifizieren, der sowohl bei P. lurida als auch bei verschiedenen anderen Pseudomonas-Arten mit der Anpassung an das Wirtslebewesen zusammenhängt“, fasst Obeng zusammen.
Evolution der Mikroorganismen als Treiber von Symbiosen
Die neuen Ergebnisse des SFB 1182-Forschungsteams tragen dazu bei, den evolutionären Ursprung von Wirts-Mikroben-Assoziationen besser zu verstehen und die bisher vor allem auf vielzellige Wirtslebewesen zentrierten Erklärungsansätze zur Symbiose-Entstehung zu erweitern. „Besonders interessant ist, dass c-di-GMP bisher vor allem als Regulator für die Virulenz verschiedener Krankheitserreger bekannt ist. Unsere Ergebnisse belegen, dass c-di-GMP generell für eine Wirtsanpassung wichtig ist – unabhängig davon, ob es sich um Krankheitserreger oder vorteilhafte Mikroben handelt“, betont Professor Hinrich Schulenburg, Leiter der Arbeitsgruppe Evolutionsökologie und Genetik.
Die weitere Erforschung dieser Zusammenhänge könne künftig beim Verständnis der zellulären Prozesse helfen, die Bakterien nutzen, um zeitweilig oder permanent in symbiotische Lebensweisen einzutreten, und daraus für sie vorteilhafte ökologische Strategien ableiten - so zum Beispiel, indem sie ihre Wirte als Vektoren zur Erschließung neuer Lebensräume nutzen. „Insgesamt zeigt unsere Arbeit erneut, dass mit der experimentellen Evolution von bakteriellen Symbionten des Fadenwurms C. elegans ein ideales Modellsystem zur Verfügung steht, um fundamentale Mechanismen von Wirt-Mikroben-Interaktionen aufzuklären und zu verallgemeinern“, so Schulenburg, Vize-Sprecher des SFB 1182.