Proteinfabriken ans Laufen bringen – Wie deubiquitinierende Enzyme auch als Fubi-Proteasen wirken
Max-Planck-Forschende identifizieren Mechanismen von Schlüsselspielern im Reifungsprozess von Ribosomen mit chemisch-biologischem Werkzeugkasten
Das kleine Protein Ubiquitin ist vor allem dafür bekannt, Proteine für den Abbau zu markieren, es reguliert jedoch auch praktisch alle zellulären Prozesse. Parallel zum Ubiquitin-System existieren verschiedene andere Ubiquitin-ähnliche Modifikator-Proteine. Eines davon ist Fubi, dass trotz seiner immunmodulatorischen Aktivität bisher kaum untersucht ist. Forschende um Malte Gersch, Forschungsgruppenleiter am Chemical Genomics Centre des Max-Planck-Instituts für molekulare Physiologie, haben nun erste molekulare Einblicke in die Maschinerie gewonnen, die die Fubi-gesteuerte Reifung eines Schlüsselproteins des Ribosoms, der Proteinfabrik der Zelle, ermöglicht. Mit Hilfe eines neu entwickelten chemischen Baukastens charakterisierten die Forschenden, wie zwei deubiquitinierende Enzyme eine spezifische Fubi-Hydrolase-Aktivität bereitstellen und damit in zwei Stufen als Fubi-Proteasen auftreten.
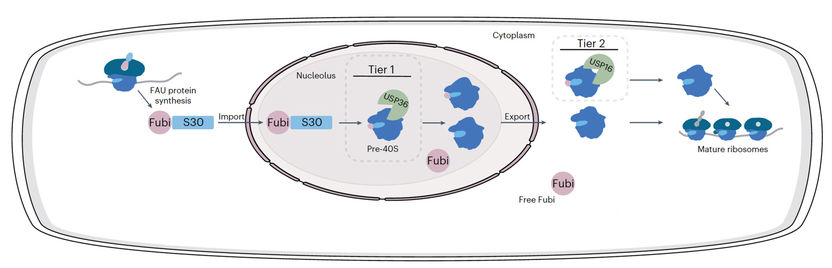
Schematische Darstellung der vorgeschlagenen zweistufigen Verarbeitung von Fubi-S30 und dem Fubi-System.
MPI für molekulare Physiologie
Fubi wird von Zellen als Fusionsprotein mit dem ribosomalen Protein S30 hergestellt. Um funktionierende Ribosomen zu erhalten, muss Fubi durch Proteasen von S30 getrennt werden. In Immunzellen wird dieses Nebenprodukt der Ribosomenproduktion als Signalmolekül genutzt, um zum Beispiel die Aktivität des mütterlichen Immunsystems in der Gebärmutter lokal zu reduzieren und so die Einnistung von Embryonen zu ermöglichen. Wie Fubi spezifisch von Proteasen erkannt wird und wie diese es von Ubiquitin unterscheiden, war bisher unbekannt.
Die Erstautorin Rachel O'Dea und Malte Gersch erläutern ihre Forschung im Detail:
Was ist die Entdeckung, die Sie gemacht haben, und warum ist sie so spannend?
"Unser Team hat gezeigt, wie zwei deubiquitinierende Enzyme auch als Proteasen des Ubiquitin-ähnlichen Proteins Fubi fungieren können, und hat Erkenntnisse auf molekularer Ebene darüber gewonnen, auf welche spezifische Weise dies möglich ist. Bemerkenswert dabei ist, dass Ubiquitin und Ubiquitin-ähnliche Proteine trotz ihrer Ähnlichkeit normalerweise von unterschiedlichen Enzymen reguliert werden. Wir zeigen, dass diese doppelte Aktivität spezifisch für die beiden Enzyme USP16 und USP36 ist, und unsere kristallographischen Studien erklären mechanistisch, wie diese seltene Kreuzreaktivität zustande kommt. Überraschenderweise haben wir, anders als bei kreuzreaktiven Enzymen aus Bakterien oder Viren, keine zusätzlichen Strukturelemente gefunden, die die zusätzliche Fubi-Aktivität dieser gut charakterisierten Ubiquitin-Proteasen ermöglichen. Stattdessen wird die Fubi-Erkennung durch ein kleines kryptisches Motiv auf einer komplementären Bindungsoberfläche vermittelt."
Was ist das Besondere an dem von Ihnen entwickelten Toolkit?
"Möglicherweise liegt es an der ungewöhnlichen Aminosäurenzusammensetzung, dass Protein-Reagenzien für Fubi bisher noch nicht zum Instrumentarium für die Untersuchung von Ubiquitin und Ubiquitin-ähnlichen Proteinen hinzugefügt wurden. Unsere Arbeit zeigt einfache Wege zur Herstellung von Fubi-Tools, die von anderen Forschenden auf diesem Gebiet leicht übernommen werden können. Die hier beschriebenen Sonden und das fluoreszierende Fubi-Substrat bieten die Möglichkeit, die Aktivität von Fubi-Proteasen sowohl in der Zelle als auch in vitro zu messen."
Warum ist Ihre Forschung für die wissenschaftliche Gemeinschaft wichtig?
"Unsere Arbeit bietet neue molekulare Einblicke in die Art und Weise, wie Enzyme in verschiedenen Modifikationssystemen aktiv sein können. Welche Rolle USP16 und USP36 bei der Reifung ribosomaler Proteine spielen, erweitert unser Verständnis der Regulationsmechanismen bei diesem kritischen zellulären Prozess. Fubi wurde in erster Linie von Immunologen und in jüngerer Zeit auch von Forschenden aus dem Bereich der Ribosomen untersucht. Mit unserer Arbeit nähern wir uns dem Thema aus der Ubiquitin-Perspektive, und ergänzen so die bisherigen Ergebnisse. Alle Daten ergeben zusammen ein zweistufiges Modell für die Verarbeitung von Fubi.
Warum ist Ihre Forschung für die Gesellschaft wichtig?
Aufgrund ihrer schnellen und reversiblen Natur sind posttranslationale Modifikationen durch Ubiquitin und Ubiquitin-ähnlichen Proteinen kritische Regulatoren für praktisch alle zellulären Prozesse. Fubi wird mit immunmodulatorischen Funktionen in Verbindung gebracht und verändert Proteine während der Stimulation von Immunreaktionen. Das Verständnis der genauen Rolle von Fubi in diesem Prozess wird unser Verständnis darüber erweitern, wie Zellen auf Immunsignale reagieren."
Was sind die nächsten Schritte, die Sie unternehmen werden?
"Unsere Ergebnisse über die Erkennung von Fubi ermöglichen eine modulierbare Fubi-Proteaseaktivität in Zellen und ebnen damit den Weg für ein besseres Verständnis der zellulären Rolle dieses rätselhaften Proteins als posttranslationale Modifikation. Darüber hinaus nutzen wir die Sonden, um den molekularen Mechanismus zu untersuchen, durch den andere Proteine mit Fubi interagieren. Aber zuerst werden wir diesen Erfolg feiern."




















































