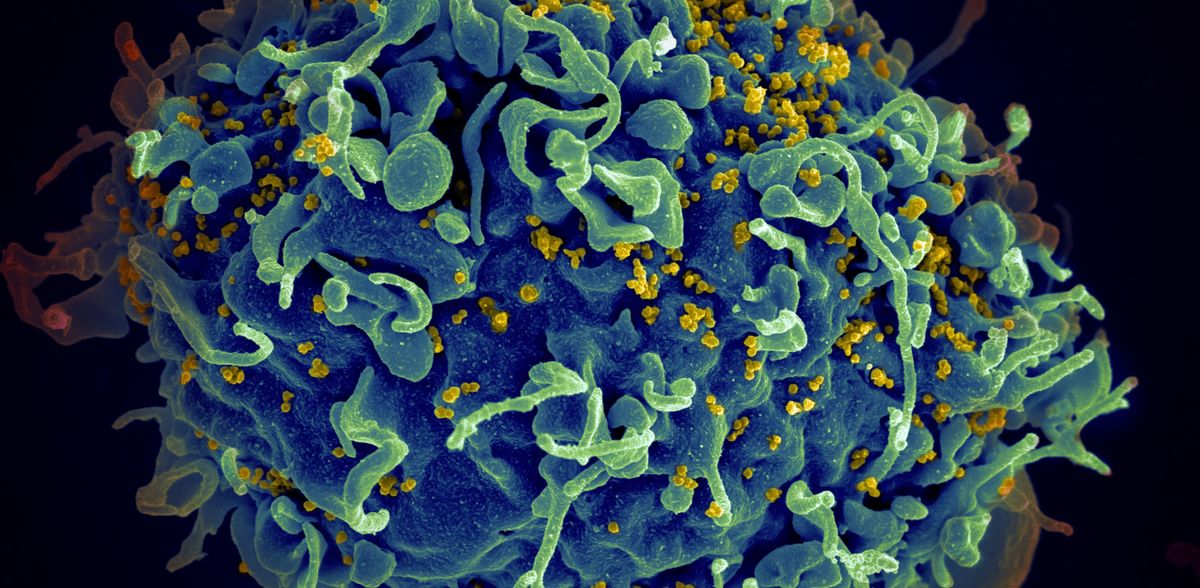
Wie HIV in den Zellkern schlüpft: Entschlüsselung des Weges bietet Aussicht auf Infektionsblockade
Forschende der Technischen Universität Dresden und der Touro University in Nevada haben entdeckt, welchen Weg das Humane Immundefizienz-Virus (HIV) nutzt, um in den Kern einer gesunden Zelle einzudringen, wo es sich vermehren und weitere Zellen infiltrieren kann. Die Forschenden haben drei Proteine identifiziert, die das Virus für die Invasion benötigt. Sie haben ihrerseits Moleküle synthetisiert, die auf eines der Proteine abzielen. In Zukunft könnten so Therapien entwickelt werden, die eine Infektion mit HIV verhindern.
Für eine HIV-Infektion muss das Virus in eine Zelle eindringen und sich Zugang zum gut bewachten Zellkern verschaffen, um virale Komponenten in die DNA der gesunden Zelle einzubauen. Wie es den Viren gelingt, die schützende Membran zu überwinden, ist jedoch unklar und Gegenstand zahlreicher Diskussionen. Ein internationales Forschungsteam unter der gemeinsamen Leitung von Dr. Denis Corbeil vom Biotechnologischen Zentrum (BIOTEC) der TU Dresden und Prof. Aurelio Lorico von der Touro University in Nevada hat nun herausgefunden, wie HIV in den Zellkern schlüpft.
"Wir haben einen Proteinsignalweg aufgedeckt, der einen direkten Einfluss auf Krankheiten zu haben scheint, was einen neuen Bereich für die mögliche Entwicklung von Medikamenten eröffnet", sagt Dr. Aurelio Lorico, Professor für Pathologie und vorläufiger Forschungsleiter am Touro University Nevada College of Osteopathic Medicine.
Die neu entdeckte Proteinkaskade beginnt damit, dass HIV in ein Membranpaket, ein so genanntes Endosom, verpackt in eine Zelle eindringt. Das virushaltige Endosom drückt die schützende Kernmembran nach innen und bildet eine Einstülpung, die so genannte Kerninvagination. Das Endosom bewegt sich dann innerhalb der Einstülpung zu ihrer inneren Spitze, an der das Virus in den Zellkern schlüpft.
Die Studie ergab, dass drei Proteine für die Invasion entscheidend sind. Eines dieser Proteine (Rab7) befindet sich an der Endosomenmembran, das zweite (VAP-A) an der Kernmembran, an der die Invasion stattfindet, und das dritte (ORP3) verbindet die ersten beiden Proteine miteinander. Für eine erfolgreiche Invasion ist eine Interaktion zwischen den drei Proteinen erforderlich, so dass die gezielte Blockade eines dieser Proteine die Infektion stoppen könnte. Das Team synthetisierte und testete Moleküle, welche die Interaktion zwischen diesen Proteinen unterbrechen. Die Forschenden beobachteten, dass die HIV-Replikation in Gegenwart dieser Moleküle nicht stattfindet.
Obwohl sich die Forschung noch im präklinischen Stadium befindet, könnten neue Medikamente, die auf dieser Studie basieren, potenziell eine therapeutische Wirkung bei AIDS haben. Auch andere Viruserkrankungen und metastasierender Krebs, bei welchen der Kerntransport von extrazellulären Partikeln erforderlich ist, könnten Ziel dieser Therapien sein.
„Da dieser neue Ansatz auch auf andere Erkrankungen wie Krebs angewendet werden kann, ist es sehr interessant, alle beteiligten molekularen Akteure weiter zu entschlüsseln, was zu neuen Therapien in der Virologie und Onkologie führen könnte", sagt Dr. Denis Corbeil, Co-Autor der Studie und Forschungsgruppenleiter am Biotechnologischen Zentrum (BIOTEC) der TU Dresden.
Die Studie, HIV-1-induzierte Kerninvaginationen, die durch den VAP-A-, ORP3- und Rab7-Komplex vermittelt werden, erklärt die Infektion aktivierter T-Zellen. Sie ist das Ergebnis einer Zusammenarbeit von Forschenden der Touro University Nevada College of Osteopathic Medicine, des Touro College of Osteopathic Medicine in New York, Forschenden des Biotechnologischen Zentrums (BIOTEC) der TU Dresden in Deutschland und Forschenden aus Italien.
Originalveröffentlichung
Mark F. Santos, Germana Rappa, Jana Karbanová, Patrizia Diana, Girolamo Cirrincione, Daniela Carbone, David Manna, Feryal Aalam, David Wang, Cheryl Vanier, Denis Corbeil and Aurelio Lorico: "HIV-1-induced nuclear invaginations mediated by VAP-A, ORP3, and Rab7 complex explain infection of activated T cells."; Nature Communications (August 2023)