Should I stay or should I go: Doppelstrategie von Spitalkeim
Warum P. aeruginosa so erfolgreich im Besiedeln von Oberflächen ist
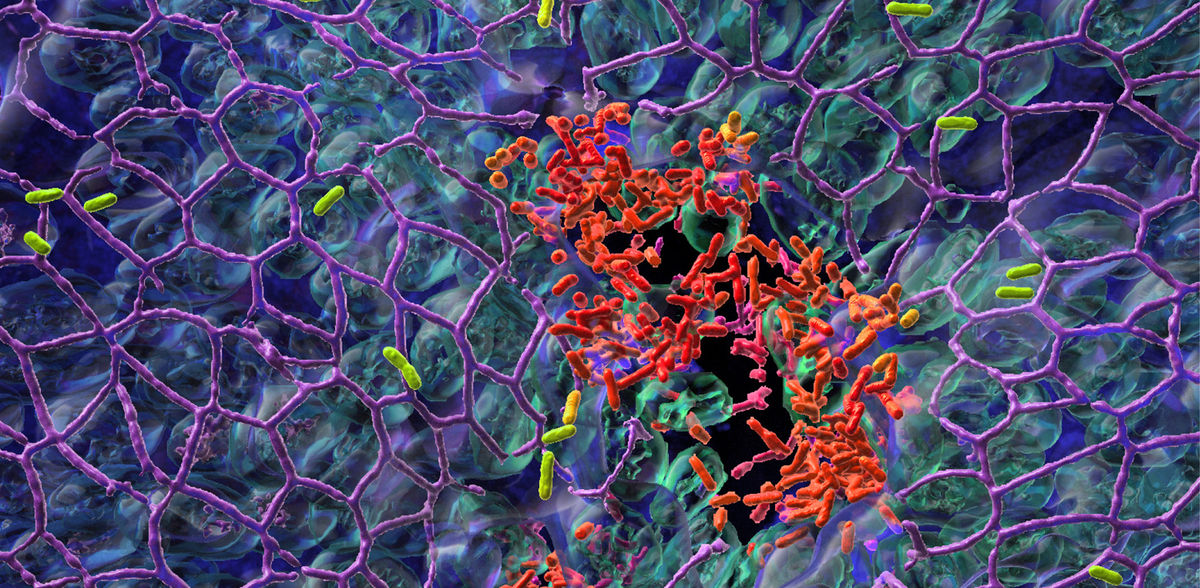
Infektionen zählen zu den häufigsten Komplikationen während eines Spitalaufenthaltes. Forschende der Universität Basel haben nun aufgeklärt, warum ein gefährlicher Spitalkeim so schwer zu bekämpfen ist. Er fährt eine zweigleisige Strategie: Einige Bakterien setzen sich auf Gewebeoberflächen fest, andere breiten sich im Körper aus. Die Studie liefert wichtige Einblicke in das Infektionsgeschehen und damit zur Bekämpfung des Erregers.
In der Schweiz ist es kein Einzelfall, dass sich Patienten im Spital mit einem Keim infizieren. Ein Grund sind Hygienemängel, wie erst kürzlich eine Studie der Heilmittelbehörde Swissmedic zeigte. Jährlich sterben geschätzt 6000 Patienten an einer Spitalinfektion. Ein gefürchteter Spitalkeim ist Pseudomonas aeruginosa. Dieses widerstandsfähige Bakterium besiedelt Hautoberflächen und Schleimhäute und kann insbesondere bei immungeschwächten Patienten lebensbedrohliche Lungenentzündungen hervorrufen.
Die Forschungsgruppe von Prof. Dr. Urs Jenal vom Biozentrum, Universität Basel, hat nun herausgefunden, warum P. aeruginosa so erfolgreich im Besiedeln von Oberflächen ist: Es setzt auf Arbeitsteilung. Während ein Teil der Bakterienpopulation sich auf der Schleimhaut in Form eines Biofilms festsetzt, schwärmt der andere Teil aus, um weite Bereiche des Gewebes zu besiedeln. Durch die Job-Aufteilung gelingt es den Bakterien, sich erfolgreich auf Gewebeoberflächen niederzulassen. Im Schutz des Biofilms trotzen sie sogar Antibiotika-Therapien.
Arbeitsteilung: bewegliche und sesshafte Bakterien
In ihrer kürzlich in «Nature Microbiology» erschienen Studie berichten die Forschenden von einem genetischen Zufallsschalter, der für die Aufgabenverteilung zuständig ist und damit über die Lebensweise der Bakterien – beweglich oder sesshaft – entscheidet. Nach der Erstbesiedlung der Schleimhaut vermehren sich die Keime also nicht einfach aufs Geratewohl, sondern bilden zwei verschiedene Typen von Nachkommen.
Der Grund dafür sind unterschiedliche Mengen des bakteriellen Botenstoffs c-di-GMP. Bakterien mit einem hohen c-di-GMP-Spiegel setzen sich fest und leben in einer Biofilm-Gemeinschaft. Diejenigen mit geringen Spiegeln sind mobil und schwärmen in das umliegende Gewebe aus, um sich an anderer Stelle in der Lunge anzusiedeln. Die Konzentration von c-di-GMP und damit das Verhalten der Bakterien, regelt dieser Schalter rein nach dem Zufallsprinzip.
«Stick and run» Mechanismus
«Die Arbeitsteilung erlaubt es den Bakterien rasch auf verschiedenste Arten von Stress oder widrige Lebensbedingungen zu reagieren, denn zu jeder Zeit gibt es einige unter ihnen, die optimal angepasst sind und überleben», erklärt Dr. Christina Manner, Erstautorin der Studie. Bakterien in der Biofilm-Gemeinschaft sind beispielsweise vor Angriffen durch Immunzellen geschützt, zugleich können alle beweglichen Bakterientypen neues Terrain erobern. Diese Aufgabenteilung wird auch als «stick and run» Mechanismus bezeichnet: bleiben und gehen.
«Wir verstehen jetzt besser, wie es Pseudomonas aeruginosa gelingt, auf der Lungenschleimhaut so gut zu gedeihen und sich dort dauerhaft einzunisten», sagt Projektleiter Urs Jenal. «Mit der Identifizierung des genetischen Schalters haben wir eine Achillesferse des Erregers entdeckt.» Die Studie liefert somit nicht nur wertvolle Einblicke in das Infektionsgeschehen, sondern zeigt neue therapeutische Möglichkeiten auf, um Infektionen mit dem gefährlichen Spitalkeim in den Griff zu bekommen.
«Wir haben zeigen können, dass der kürzlich entdeckte Anti-Biofilm Wirkstoff Disperazol über denselben Mechanismus wirkt und den Schalter so umlegt, dass nur bewegliche Pseudomonas-Typen entstehen. Dadurch löst sich der Biofilm komplett auf», fügt Jenal hinzu. «Das ist ein grosser Fortschritt, denn mit solchen Verbindungen eröffnen sich neue Möglichkeiten, gefährlichen und schwer zu bekämpfenden Biofilmen auf den Leib zu rücken.»
Originalveröffentlichung
Christina Manner, Raphael Dias Teixeira, Dibya Saha, Andreas Kaczmarczyk, Raphaela Zemp, Fabian Wyss, Tina Jaeger, Benoit-Joseph Laventie, Sebastien Boyer, Jacob G. Malone, Katrine Qvortrup, Jens Bo Andersen, Michael Givskov, Tim Tolker-Nielsen, Sebastian Hiller, Knut Drescher & Urs Jenal; A genetic switch controls Pseudomonas aeruginosa surface colonization; Nature Microbiology; 2023