Infektionsmodell aus dem 3D-Drucker
Forschende drucken bakterielle Biofilme auf humane Lungenzellen, um chronische Lungeninfektionen zu untersuchen
Einige bakterielle Krankheitserreger bilden im Rahmen von Infektionsprozessen sogenannte Biofilme, um sich vor Medikamenten oder Zellen des menschlichen Immunsystems zu schützen. Pro Jahr sterben über 500.000 Menschen an Infektionen, die mit Biofilmen assoziiert sind. Forschende am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) haben nun eine neuartige Methode entwickelt, um solche Biofilme im Labor gezielt auf Lungenzellen aufzubringen. Das mittels „Bioprinting“ hergestellte Modellsystem soll dabei helfen, Infektionsprozesse besser zu verstehen und bei der Erforschung neuer Wirkstoffe helfen. Ihre Ergebnisse haben die Forschenden in der Fachzeitschrift Biofabrication veröffentlicht.
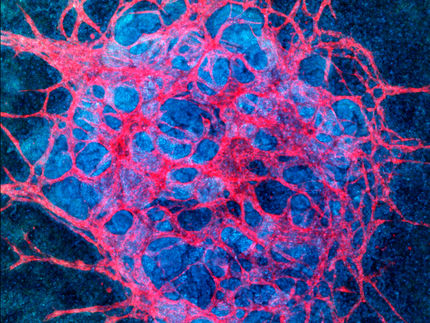
Fluoreszenzmikroskopische Aufnahme von auf Lungenepithelzellen gedruckten Biofilmen.
Licensed under CC BY 4.0, Aliyazdi et al. 2023, Biofabrication. DOI: 10.1088/1758-5090/acd95e
Um neue Therapeutika gegen Infektionen entwickeln zu können, sind Forschende auf Labormodelle angewiesen, die es ihnen erlauben, den Infektionsprozess nachzustellen und untersuchen zu können. Insbesondere in der frühen Testung und Entwicklung von Wirkstoffen sind diese Modelle unabdingbar, um die Zahl der notwendigen Tierversuche möglichst gering zu halten. Im Fall von Biofilm-assoziierten Infektionen sind Modellsysteme sehr komplex, da mit dem Biofilm neben humanen Zellen und den Krankheitserregern noch eine weitere Komponente ins Spiel kommt, die möglichst naturgetreu nachgebildet werden muss. Einem Team um Claus-Michael Lehr, Leiter der Abteilung Wirkstofftransport über Biologische Barrieren am HIPS und Professor für Biopharmazie und Pharmazeutische Technologie an der Universität des Saarlandes, ist es nun gelungen, ein solches Modellsystem zu entwickeln und zu charakterisieren. Das HIPS ist ein Standort des Helmholtz-Zentrums für Infektionsforschung (HZI) in Zusammenarbeit mit der Universität des Saarlandes.
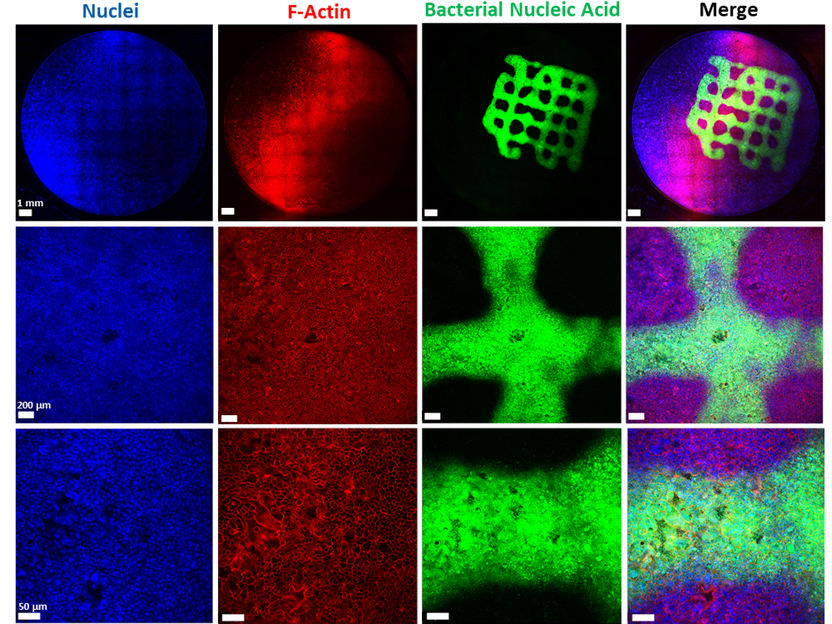
In der veröffentlichten Studie werden die bakteriellen Zellen, inklusive Biofilm, durch einen speziellen 3D-Drucker auf eine Schicht aus Lungenepithelzellen aufgebracht. Bei diesem sogenannten „Bioprinting“ handelt es sich um einen komplexen Prozess, der eine Tinte mit speziellen Eigenschaften erfordert. „Die Entwicklung eines Biofilm-Infektionsmodells ist nicht trivial, da das schnelle Wachstum der Bakterien und die Freisetzung von Toxinen leicht zu einem vorzeitigen Absterben der Lungenzellen führen kann. Dementsprechend erfordert die Aufrechterhaltung des Biofilms in einem solchen System eine sehr kontrollierte Umgebung“, erklärt Claus-Michael Lehr. „Wir haben unsere 3D-gedruckten Biofilme so optimiert, dass sie einem nativen Biofilm sehr nah kommen. Eine große Herausforderung war, dass die künstlichen Biofilme nach dem Abwaschen der überschüssigen Biotinte ihre Form erhalten und keinen toxischen Effekt auf die darunterliegenden Lungenzellen haben. Beides hat mit dem entwickelten Modell zu ermutigenden Ergebnissen geführt.“ Um die Biokompatibilität mit humanen Zellen zu prüfen, wurden die Biofilme auf humane Bronchialepithelzellen gedruckt. Die erzeugten Konstrukte wurden unter anderem mit Fluoreszenz- und Elektronenmikroskopie überprüft und nach und nach optimiert. Auch die Empfindlichkeit der Bakterien im Biofilm gegenüber klinisch verwendeten Antibiotika wurde untersucht. Die gedruckten Biofilme führten zu einem ähnlichen Schutz der Bakterien vor einer Behandlung mit Antibiotika wie native Biofilme und eignen sich daher hervorragend, um eine entsprechende Behandlung simulieren zu können.
„Unsere Methode kann nun für die Analyse gleich mehrerer Aspekte einer Biofilm-assoziierten Infektion verwendet werden, einschließlich Morphologie, Antibiotikaempfindlichkeit oder Änderungen im Stoffwechsel“, sagt Samy Aliyazdi, Doktorand in der Abteilung von Claus-Michael Lehr und Erstautor der Studie. „Mittels 3D-Bioprinting konnten wir ein robustes humanbasiertes in vitro-Modell generieren, das wir nun für die Entwicklung neuer Anti-Infektiva einsetzen wollen.“