Schlecht isolierte Nervenzellen fördern Alzheimer im Alter
Ergebnisse der Studie zeigen erstmals, dass defektes Myelin im alternden Gehirn das Risiko erhöht, dass sich Aꞵ-Peptide ablagern
Die Alzheimer’sche Krankeit ist eine irreversible Form der Demenz und gilt als weltweit häufigste neurodegenerative Erkrankung. Der wichtigste Risikofaktor für diese Krankheit ist das Alter, allerdings ist noch unklar, warum. Bekannt ist, dass die Isolierschicht um Nervenzellen im Gehirn, Myelin genannt, im Alter degeneriert. Forschende am Göttinger Max-Planck-Institut (MPI) für Multidisziplinäre Naturwissenschaften konnten nun zeigen, dass defektes Myelin krankheitsbedingte Veränderungen bei Alzheimer aktiv fördert. Ein Verlangsamen der altersabhängigen Myelin-Schädigung könnte zukünftig neue Wege eröffnen, die Alzheimer-Krankheit zu verhindern oder ihr Fortschreiten hinauszuzögern.
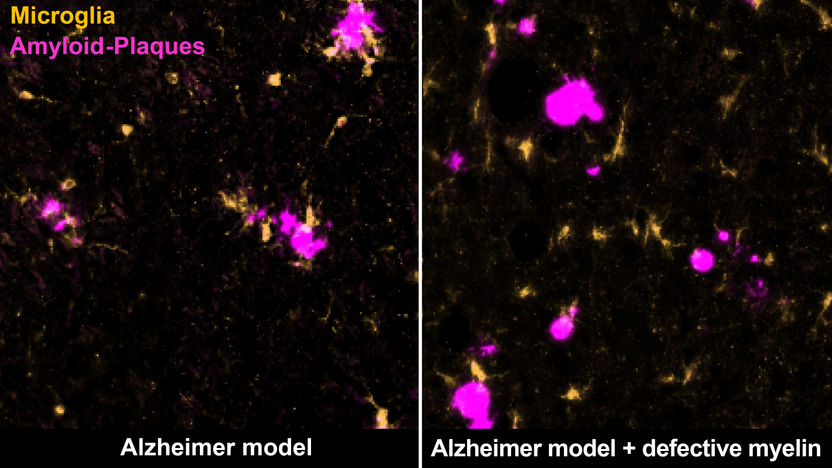
Bestimmte Immunzellen, die Mikroglia (gelb), beseitigen Amyloid-Plaques (magenta) im Gehirn einer Alzheimer-Maus (links). Degenerierendes Myelin lenkt sie davon ab (rechts).
Max Planck Institute for Multidisciplinary Sciences
Was wollte ich gerade machen? Wo habe ich den Schlüssel hingelegt? Wann war nochmal der Termin? Es beginnt mit leichten Gedächtnislücken, dann folgen zunehmende Probleme, sich zu orientieren, Gesprächen zu folgen, sich auszudrücken, einfache Handgriffe zu tätigen. In der letzten Phase sind Betroffene meist pflegebedürftig. Die Alzheimer-Krankheit verläuft schleichend und betrifft vor allem ältere Menschen. Das Risiko, an Alzheimer zu erkranken, verdoppelt sich ab dem 65. Lebensjahr alle fünf Jahre.
Alterserscheinungen im Gehirn
„Die grundlegenden Mechanismen für den Zusammenhang zwischen Alter und Alzheimer sind noch nicht aufgeklärt“, erklärt Klaus-Armin Nave, Direktor am MPI für Multidisziplinäre Naturwissenschaften. Mit seiner Abteilung Neurogenetik erforscht er die Funktion des Myelins, der fettreichen Isolierschicht der im Gehirn verlaufenden Nervenfasern von Nervenzellen. Myelin sorgt für die schnelle Kommunikation zwischen Nervenzellen und unterstützt deren Stoffwechsel. „Intaktes Myelin ist entscheidend für eine normale Gehirnfunktion. Wir konnten zeigen, dass altersbedingte Veränderungen des Myelins pathologische Veränderungen der Alzheimer’schen Krankheit fördern“, so der Max-Planck-Forscher.
In einer neuen Studie, die jetzt im Wissenschaftsmagazin Nature veröffentlicht wurde, gingen die Forschenden der möglichen Rolle des altersbedingten Myelin-Abbaus bei der Entstehung von Alzheimer auf den Grund. Im Fokus ihrer Arbeit lag ein typisches Merkmal der Demenzerkrankung: „Kennzeichnend für Alzheimer sind die Ablagerungen bestimmter Proteine im Gehirn, die sogenannten Amyloid-Beta-Peptide oder kurz Aꞵ-Peptide“, erklärt Constanze Depp, eine der beiden Erstautorinnen der Studie. „Die Aꞵ-Peptide verklumpen miteinander zu Amyloid-Plaques. Bei Betroffenen bilden sich diese Plaques bereits viele Jahre und sogar Jahrzehnte, bevor erste Alzheimer-Symptome auftreten.“ Im Verlauf der Erkrankung sterben Nervenzellen schließlich irreversibel ab und die Informationsübertragung im Gehirn wird gestört.
Mithilfe bildgebender sowie biochemischer Verfahren untersuchten und verglichen die Forschenden verschiedene Mausmodelle der Alzheimer-Krankheit, in denen ähnlich wie bei Alzheimer-Patient*innen Amyloid-Plaques auftreten. Erstmals untersuchten sie aber Alzheimer-Mäuse, die zusätzlich Myelin-Defekte aufwiesen, wie sie auch bei fortgeschrittenem Alter im menschlichen Gehirn auftreten.
Ting Sun, die zweite Erstautorin der Studie, beschreibt die Ergebnisse: „Wir haben gesehen, dass der Myelin-Abbau die Ablagerung von Amyloid-Plaques im Gehirn von Alzheimer-Mausmodellen beschleunigt. Das defekte Myelin belastet die Nervenfasern, sodass sie anschwellen und mehr Aꞵ-Peptide bilden.“
Überforderte Immunzellen
Gleichzeitig erregen die Myelin-Defekte die Aufmerksamkeit von Immunzellen des Gehirns, den Mikroglia. „Diese Zellen sind sehr wachsam und kontrollieren das Gehirn auf jedes Anzeichen einer Beeinträchtigung. Sie können Stoffe, wie zum Beispiel tote Zellen oder Zellbestandteile, aufnehmen und zerstören“, so Depp. Normalerweise erkennen und beseitigen die Mikroglia Amyloid-Plaques und halten so die Ablagerungen in Schach. Werden die Mikroglia jedoch sowohl mit defektem Myelin als auch mit Amyloid-Plaques konfrontiert, entfernen sie in erster Linie die Myelin-Reste, während sich die Plaques weiter ansammeln können. Die Forschenden vermuten, dass die Mikroglia durch die Myelinschäden ‚abgelenkt‘ oder überfordert sind, und so nicht richtig auf Plaques reagieren können.
Die Ergebnisse der Studie zeigen erstmals, dass defektes Myelin im alternden Gehirn das Risiko erhöht, dass sich Aꞵ-Peptide ablagern. „Wir hoffen damit auch zu neuen Therapien zu kommen. Gelänge es, altersabhängige Myelin-Schädigungen zu bremsen, könnte dies auch die Alzheimer-Krankheit verhindern oder verlangsamen“, erklärt Nave.