Mix and Match: Wie eine methanogene Mikrobe die Sulfatreduktion meistert
Entdeckung eröffnet spannende Möglichkeiten für die Produktion von Biokraftstoff
Forschende des Max-Planck-Instituts für Marine Mikrobiologie in Bremen lüften die molekularen Geheimnisse einer methan-bildenden Mikrobe, die Sulfat in Sulfid umwandeln kann – einen gebrauchsfertigen Baustein für Zellen. Ihre Entdeckung eröffnet spannende Möglichkeiten für die Produktion von Biokraftstoff.

Doktorandin Marion Jespersen bei der Arbeit an einem Fermenter, in dem M. thermolithotrophicus ausschließlich auf Sulfat als Schwefelquelle wächst.
Tristan Wagner, Max-Planck-Institut für Marine Mikrobiologie
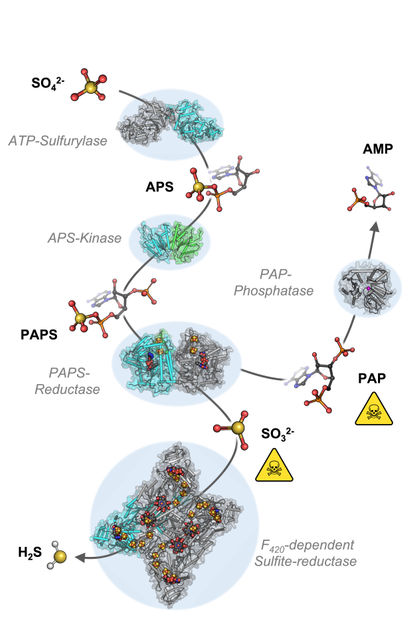
Die Kaskade der chemischen Reaktion ausgehend von Sulfat (SO42- ) zu Sulfid (H2 S).
Marion Jespersen, Max-Planck-Institut für Marine Mikrobiologie

Schwefel, ein unverzichtbarer Baustein des Lebens
Schwefel ist ein grundlegendes Element des Lebens. Alle Lebewesen benötigen ihn, um Material für ihre Zellen herzustellen. Autotrophe Organismen wie Pflanzen und Algen gewinnen Schwefel, indem sie Sulfat in Sulfid umwandeln, das in die Biomasse eingebaut werden kann. Dieser Prozess braucht jedoch sehr viel Energie und erzeugt schädliche Zwischen- und Nebenprodukte, die sofort weiterverarbeitet werden müssen. Lange Zeit nahm man daher an, dass sogenannte methanogene (methanbildende) Mikroben, die meist wenig Energie zur Verfügung haben, nicht in der Lage wären, Sulfat in Sulfid umzuwandeln. Man vermutete, dass diese Mikroben, die die Hälfte des weltweiten Methans produzieren, auf andere Formen von Schwefel angewiesen wären, etwa auf Sulfid.
Eine methanogene Mikrobe, die Sulfat verwertet?
Dieses Dogma wurde 1986 widerlegt mit der Entdeckung von Methanothermococcus thermolithotrophicus – einem Methanogen, das Sulfat als einzige Schwefelquelle nutzt. Wie ist das möglich angesichts der energetischen Kosten und giftigen Zwischenprodukte? Warum ist es augenscheinlich das einzige Methanogen, das auf dieser Schwefelart wachsen kann? Nutzt diese Mikrobe chemische Tricks oder eine bisher unbekannte Strategie, um Sulfat zu assimilieren? Marion Jespersen und Tristan Wagner vom Max-Planck-Institut für Marine Mikrobiologie haben nun Antworten auf diese Fragen gefunden und in der Zeitschrift Nature Microbiology veröffentlicht.
Zunächst standen die Forschenden vor der Herausforderung, diese Mikrobe mit der neuen Schwefelquelle zum Wachsen zu bringen. „Als ich meine Doktorarbeit begann, musste ich M. thermolithotrophicus erst einmal davon überzeugen, Sulfat statt Sulfid zu essen,“ berichtet Marion Jespersen. „Aber nachdem ich das Nährmedium optimiert hatte, wurde Methanothermococcus zum Experten für das Wachsen auf Sulfat und erreichte ähnliche Zelldichten wie beim Wachstum auf Sulfid.“
„Richtig spannend wurde es, als wir eine Abnahme der Sulfatwerte maßen, während der Organismus wuchs. Das war der Moment, an dem wir wirklich beweisen konnten, dass das Methanogen diese Substanz verwertet.“ Nun war es den Forschenden möglich, M. thermolithotrophicus sicher in Bioreaktoren in großem Maßstab zu kultivieren, denn sie waren nicht auf das giftige und explosive Schwefelwasserstoffgas angewiesen. „So konnten wir genügend Biomasse erzeugen, um diese faszinierende Mikrobe zu erforschen“, erklärt Jespersen. Nun konnte sie die zugrundeliegenden Prozesse genau erforschen.
Die erste molekulare Aufschlüsselung der Sulfat-Assimilation
Um die molekularen Mechanismen der Sulfatassimilation zu verstehen, untersuchten die Forschenden das Genom von M. thermolithotrophicus. Sie fanden fünf Gene, die in der Lage wären, Enzyme für die Sulfatreduktion zu kodieren. „Wir haben es geschafft, jedes einzelne dieser Enzyme zu charakterisieren und somit den gesamten Stoffwechselweg zu erforschen. Eine wahre Meisterleistung, wenn man sich die Komplexität des Stoffwechselweges vor Augen führt“, sagt Tristan Wagner, Leiter der Max-Planck-Forschungsgruppe Mikrobielle Metabolismen.
Durch die individuelle Charakterisierung der Enzyme konnten die Forschenden den ersten Sulfat-Assimilationsweg eines Methanogens rekonstruieren. Während die ersten beiden Enzyme des Weges gut bekannt sind und in vielen Mikroben und Pflanzen vorkommen, waren die darauffolgenden Enzyme neuartig. „Erstaunlicherweise hat M. thermolithotrophicus offenbar ein Enzym eines dissimilierenden, sulfatreduzierenden Organismus gekapert und es leicht modifiziert, um seinen eigenen Bedürfnissen zu entsprechen“, sagt Jespersen. Während einige Mikroben Sulfat als Zellbaustein assimilieren, verwenden andere es, um in einer dissimilatorischen Reaktion Energie zu gewinnen – wie Menschen bei der Sauerstoffatmung. Die Mikroben, die diese dissimilatorische Sulfatreduktion durchführen, nutzen dazu andere Enzyme. Das hier untersuchte Methanogen hat eines dieser dissimilatorischen Enzyme in ein assimilatorisches Enzym umgewandelt. „Das ist eine einfache, aber sehr effektive Strategie und wahrscheinlich der Grund, warum dieses Methanogen auf Sulfat wachsen kann. Bisher wurde dieses spezielle Enzym nur in M. thermolithotrophicus und in keinem anderen Methanogen gefunden“, so Jespersen.
Allerdings muss M. thermolithotrophicus auch mit zwei Giftstoffen fertig werden, die bei der Assimilation von Sulfat entstehen. Dafür sind die beiden letzten Enzyme des Weges gedacht: Das erste, das wiederum einem dissimilatorischen Enzym ähnelt, wandelt Sulfit in Sulfid um. Das zweite ist eine bisher unbekannte Phosphatase, die sehr effizient das andere Gift mit dem Kurznamen PAP aufspaltet.
„Offenbar hat M. thermolithotrophicus genetische Informationen aus seiner mikrobiellen Umwelt gesammelt, die es möglich machen, auf Sulfat zu wachsen. Indem es assimilatorische und dissimilatorische Enzyme mischte und aufeinander abstimmte, schuf es seine eigene funktionstüchtige Sulfatreduktionsmaschinerie“, erklärt Wagner.
Neue Möglichkeiten für biotechnologische Anwendungen
Hydrogenotrophe Methanogene, wie M. thermolithotrophicus, haben die erstaunliche Fähigkeit, zweiwertigen Wasserstoff (H2, z.B. künstlich mit erneuerbarer Energie hergestellt) und Kohlendioxid (CO2) in Methan (CH4) umzuwandeln. Mit anderen Worten: Sie können das Treibhausgas CO2 in den Biokraftstoff CH4 umwandeln, mit dem wir zum Beispiel heizen können. Zu diesem Zweck werden Methanogene in großen Bioreaktoren gezüchtet. Ein derzeitiger Engpass bei der Kultivierung von Methanogenen ist ihr Bedarf an dem hochgefährlichen und explosiven Schwefelwasserstoffgas als Schwefelquelle. Mit der Entdeckung des Sulfat-Assimilationsweges in M. thermolithotrophicus ist es möglich, Methanogene, die bereits in der Biotechnologie eingesetzt werden, gentechnisch so zu verändern, dass sie stattdessen diesen Weg nutzen - und damit eine sicherere und kostengünstigere Biogasproduktion zu entwickeln.
„Eine dringende offene Frage ist, warum M. thermolithotrophicus in der Natur Sulfat assimilieren sollte. Dazu müssen wir das Labor verlassen und sehen, ob die für den Stoffwechselweg erforderlichen Enzyme auch in der natürlichen Umgebung dieser Mikrobe exprimiert werden“, schließt Wagner.