Zappelnde Proteine schützen das Erbgut
Dynamisches Netzwerk in den Poren der Zellkernhülle blockt gefährliche Eindringlinge ab
Winzige Poren im Kern der Zelle spielen eine essentielle Rolle für gesundes Altern, indem sie für den Schutz und Erhalt des genetischen Material sorgen. Ein buchstäbliches Loch im Wissen um den Aufbau und die Funktionsweise dieser Kernporen stopften Forschende der Theoretischen Biophysik am Max-Planck-Institut für Biophysik in Frankfurt am Main und der Synthetischen Biophysik Ungeordneter Proteine an der Johannes Gutenberg-Universität Mainz. Sie fanden heraus, dass intrinsisch ungeordnete Proteine in der zentralen Porenöffnung eine bewegliche, spaghettiartige Barriere bilden, die wichtige Botenstoffe durchlässt, aber Viren oder andere Krankheitserreger abblockt.
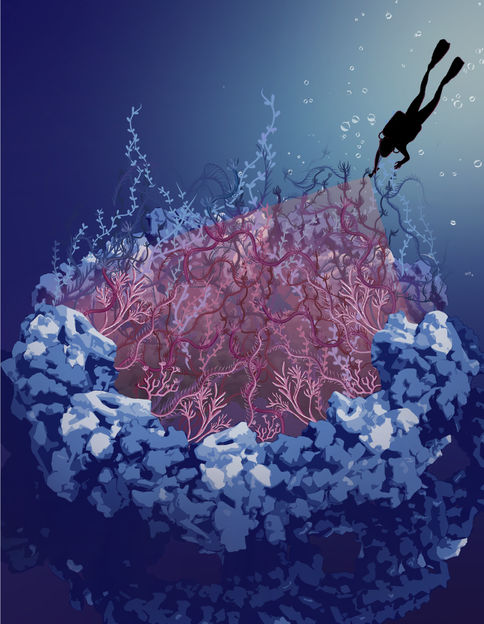
Das Bild zeigt eine künstlerische Darstellung der felsartigen Gerüststruktur des Kernporenkomplexes, die mit ungeordneten Proteinen im zentralen Kanal gefüllt ist, der als Seetang dargestellt ist.
© Sara Mingu
Menschliche Zellen speichern ihr genetisches Erbmaterial im Inneren des Zellkerns, sicher geschützt durch die Kernmembran. Als Steuerzentrale der Zelle muss der Kern wichtige Botenstoffe, Stoffwechselprodukte oder Proteine mit dem Rest der Zelle austauschen können. Dafür sind rund 2000 Poren in die Kernmembran eingebaut, die aus jeweils etwa 1000 Proteinen bestehen.
Das Rätsel um die 3D-Struktur und die Funktion dieser Kernporen, die als Wächter des Genoms fungieren, beschäftigt Forschende schon seit Jahrzehnten: Nur für die Steuerung der Zelle notwendige Substanzen dürfen in den Kern gelangen, nicht aber Krankheitserreger oder andere erbgutschädigende Stoffe. Die Zellkernporen kann man sich also wie molekulare Türsteher vorstellen, die jeweils mehrere Zehntausend Besucher pro Minute kontrollieren. Durchgelassen wird nur, wer auch eine Eintrittskarte hat.
Wie schaffen die Kernporen diese Mammutaufgabe? Eine essentielle Rolle spielen etwa 300 Proteine, die am Gerüst der Pore befestigt sind und wie Fangarme tief in die zentrale Öffnung hineinragen. Wie genau sie angeordnet sind und wie sie Eindringlinge abblocken, wussten Forschende aber bislang nicht. Denn diese Proteine bestehen aus intrinsisch ungeordneten Sequenzen ohne definierte dreidimensionale Struktur. Sie sind flexibel und bewegen sich ständig – wie Spaghetti im kochenden Wasser.
Kombination von Mikroskopie und Computersimulationen
Weil diese intrinsisch ungeordneten Proteine (IDPs, aus dem Englischen von Intrinsically Disordered Proteins) ihre Struktur laufend verändern, ist es für Wissenschaftlerinnen und Wissenschaftler schwierig, ihren dreidimensionalen Aufbau und somit auch ihre Funktion zu entschlüsseln. Die meisten Techniken, mit denen Forschende Proteine abbilden, funktionieren nur mit einer geordneten 3D-Struktur. Bisher wurde der zentrale Bereich der Kernpore als Loch dargestellt, weil es nicht möglich war, die Anordnung der IDPs in der Öffnung zu ermitteln.
Das Team um Gerhard Hummer, Direktor am Max-Planck-Institut für Biophysik, und Edward Lemke, Professor für synthetische Biophysik an der Johannes Gutenberg-Universität Mainz und Adjunct Direktor am Institut für Molekulare Biologie, hat nun eine neue Kombination aus synthetischer Biologie, multidimensionaler Fluoreszenzmikroskopie und computerbasierten Simulationen eingesetzt, um die Kernporen-IDPs in lebenden Zellen zu untersuchen.
„Wir haben die spaghettiartigen Proteine mit modernen Präzisionswerkzeugen Fluoreszenz-Farbstoffen markiert, die wir mit Licht anregen und im Mikroskop sichtbar machen können“, erklärt Lemke. „Anhand der Leuchtmuster und Leuchtdauer konnten wir ableiten, wie die Proteine angeordnet sein müssen.“ Hummer fügt hinzu: „Mit Moleküldynamik-Simulationen haben wir dann berechnet, wie die IDPs in der Porenöffnung räumlich organisiert sind, wie sie miteinander wechselwirken und sich bewegen. Zum ersten Mal konnten wir so das Tor zur Steuerzentrale der menschlichen Zellen visualisieren.“
Dynamisches Proteinnetzwerk als Transportbarriere
Die Fangarme in der Transportpore verhalten sich völlig anders als bisher gedacht, weil sie miteinander und mit der Fracht wechselwirken. Sie bewegen sich dabei ständig wie die erwähnten Spaghetti im kochenden Wasser. In der Mitte der Pore befindet sich also kein Loch, sondern ein Schutzschild aus zappelnden, spaghettiartigen Molekülen. Viren oder Bakterien sind zu groß, um durch dieses Sieb zu gelangen. Zelleigene im Kern benötigte große Moleküle können nur passieren, weil sie ganz bestimmte Signale aufweisen. Sie haben also eine Eintrittskarte, Krankheitserreger dagegen in der Regel nicht. "Indem wir die Struktur des Poreninneren entschlüsselt haben, eröffnen wir in eine neue Ära der Erforschung von Kerntransportprozessen", ergänzt Martin Beck, Mitarbeiter und Kollege am Max-Planck-Institut für Biophysik.
„Zu verstehen, wie die Poren Fracht transportieren oder blocken, hilft uns Fehler zu identifizieren. Immerhin schaffen es einige Virenschaffen es trotz der Barriere, in den Zellkern zu gelangen“, resümiert Hummer. „Mit unserer Methodenkombination können wir nun IDPs genauer untersuchen und herausfinden, warum sie für bestimmte Zellfunktionen unverzichtbar sind, obwohl sie fehleranfällig sind. Tatsächlich kommen IDPs in fast allen Spezies vor, obwohl sie das Risiko bergen, während des Alterungsprozesses Aggregate zu bilden, die zu neurodegenerativen Krankheiten wie Alzheimer führen können,“, so Lemke. Wenn Forschende verstehen, wie IDPs funktionieren, können sie neue Medikamente oder Impfstoffe entwickeln, um Virusinfektionen zu verhindern und eine gesunde Alterung zu fördern.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.