Wie Blutkrebs effektiver bekämpft werden kann
Gleichzeitige Untersuchung hunderter verschiedener Behandlungsmethoden außerhalb des Körpers in einem Durchgang
Das Multiple Myelom ist noch immer nicht heilbar. Forschende der ETH Zürich und des Universitätsspitals Zürich haben nun hunderte von Behandlungsmethoden ausserhalb des Körpers ausgetestet, um die beste Behandlungsmöglichkeit mit bestehenden Therapeutika vorauszusagen.
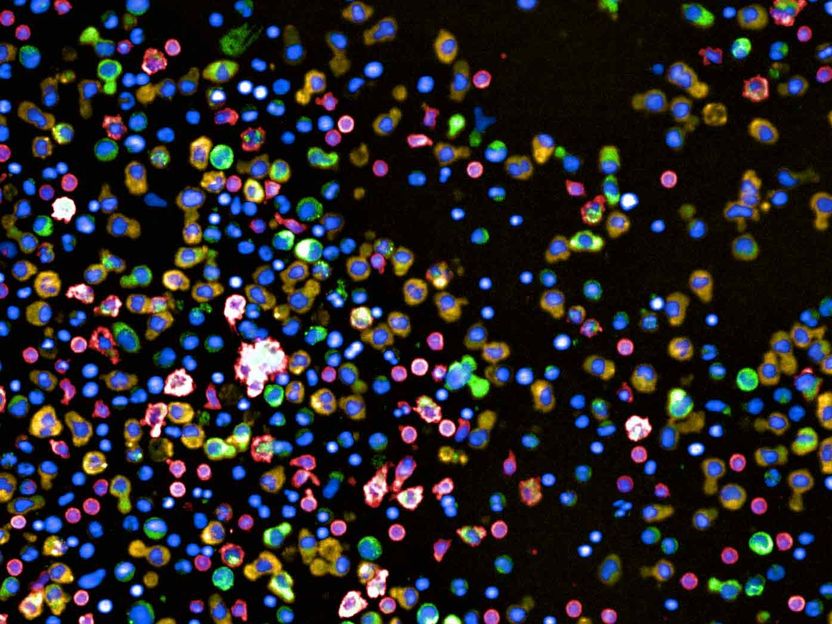
Zellen aus einer Knochenmarksbiopsie eines Patienten mit Multiplem Myelom. Rot gefärbt sind gesunde T-Zellen respektive Monozyten, grün und gelb die Plasmazellen.
Berend Snijder Lab / ETH Zürich
Das Multiple Myelom ist ein seltener Blutkrebs, bei dem sich krankhafte Plasmazellen unkontrolliert vermehren. Plasmazellen sind eine spezielle Form von weissen Blutzellen und im Knochenmark und den Lymphknoten dafür zuständig, Antikörper zu bilden. Sie sind also wichtige Zellen des Immunsystems.
Trotz einer steigenden Zahl an zugelassenen Medikamenten und Behandlungsansätzen wie der Immuntherapie ist die Krankheit nach wie vor nicht heilbar.
Eine der Schwierigkeiten ist, dass der Krebs trotz Behandlung häufig wiederkehrt. Oft macht eine Behandlung die Krebszellen resistenter gegen die eingesetzten Medikamente, bis schliesslich nach mehreren Behandlungsrunden keine wirksamen Behandlungsoptionen mehr verfügbar sind. Die mittlere Lebenserwartung von Patient:innen nach der Diagnose beträgt fünf Jahre.
ETH-Forschende haben deshalb auf einer von ihnen entwickelten Screening-Plattform nach Auswegen aus dieser Sackgasse gesucht – und gefunden. Ihre Studie dazu wurde in der Fachzeitschrift Nature Cancer veröffentlicht.
Biopsiematerial unter der Lupe
Die Forschenden nutzen dazu ein Hochdurchsatz-Screening-Verfahren, das ETH-Professor Berend Snijder in den vergangenen Jahren entwickelt hat. Die Forschenden nennen es Pharmakoskopie. Damit testen sie ausserhalb des Körpers, wie gut die Krebszellen der Patient:innen auf welche Behandlungsmethoden ansprechen.
Mehrere hundert unterschiedliche Behandlungsmethoden (verschiedene Krebsmedikamente und Kombinationen davon) können sie auf einer Platte und in einem Durchgang gleichzeitig untersuchen. Daraus, wie die Zellen reagieren, leiten sie ab, bei welchem Patienten welche Behandlungsmethode am meisten Erfolg verspricht.
Dazu werden die Zellen aus den Biopsien in jede der 384 Vertiefungen auf der Platte gegeben. In jede der Vertiefungen geben die Forschenden eine andere Kombination von Wirkstoffen. Nach 24 Stunden färben die Wissenschaftler:innen mit verschiedenen Antikörpern, und mittels automatisierter Mikroskopie werten sie die Reaktion jeder einzelnen Zelle aus. Ein Deep Learning-Algorithmus identifiziert und klassifiziert die Zelltypen. Der gesamte Ablauf ist weitgehend automatisiert.
138 Biopsien individuell ausgetestet
Damit haben die Forschenden 138 Knochenmarksbiopsien von 89 Myelom-Patient:innen genau untersucht. Die Patientenkohorte deckte alle Krankheitsstadien ab: von soeben diagnostiziert und unbehandelt bis hin zu Spätstadium mit mehrfacher Behandlung.
Ziel der Forschenden war es, in jeder einzelnen Biopsie zu beobachten, wie die Krebszellen reagieren, wenn sie den zugelassenen Wirkstoffen und Wirkstoffkombinationen von bis zu vier unterschiedlichen Substanzen sowie Immuntherapien ausgesetzt werden. Daraus, wie die Zellen reagierten, leiteten sie schliesslich ab, bei welchem Patienten, welcher Patientin welche Behandlungsmethode am meisten Erfolg verspricht.
Snijder hat die Pharmakoskopie-Plattform schon früher bei ähnlichen Studien über Lymphome und Leukämie erfolgreich eingesetzt. Für die Studie des Myeloms mussten er und sein Team sie allerdings anpassen.
Hoffnung auf effektivere Behandlungen
Den ETH-Forschenden ist es in dieser Studie sogar gelungen, neue effektivere Behandlungsoptionen ausfindig zu machen. Welche das sind, ist für jeden Patienten anders. Der Ansatz ist also ein Musterbeispiel für personalisierte Medizin.
Der neue Ansatz ist laut Snijder auf die Klinik übertragbar und kann somit Ärztinnen und Ärzten helfen, frühzeitig die beste Option für ihre Patient:innen herauszufinden. «Zuerst werden wir die Methode allerdings noch mit klinischen Versuchen weiter validieren müssen», sagt der Forscher.
Künftig möchten er und sein Team die Plattform auch dahingehend weiterentwickeln, um feste Tumore untersuchen zu können. Feste Tumore müssen im Unterschied zu Blutkrebs zuerst bis zu einem gewissen Grad aufgelöst werden, damit die Zellen auf die Platte der Pharmakoskopie-Plattform verteilt werden können. Zurzeit arbeiten Snijder und seine Mitarbeitenden daran, das Screeningverfahren unter anderem für die Untersuchung von Hirntumoren anzupassen.