Narbenlose Wundheilung: Was wir von Stachelmäusen lernen können
Ein ERK-abhängiger molekularer Schalter hemmt die Narbenbildung und fördert die Regeneration
Die Verletzungsreaktion nach Verwundungen, wie einer tiefen Hautwunde, einem Herzinfarkt, einer Rückenmarksverletzung oder einer Lungeninfektion führt in den meisten Fällen zu fibrotischem Gewebe, was zu dauerhaften Narben und einem Versagen der Organfunktionen führen kann. Man schätzt, dass etwa 50% der Menschen an einer Krankheit sterben, die mit Narbenbildung einhergeht. Ein besseres Verständnis der molekularen Mechanismen, die darüber entscheiden, ob Wunden unter Narbenbildung heilen oder ohne Narbenbildung regenerieren, ist für die Entwicklung neuer therapeutischer Strategien daher von entscheidender Bedeutung. In den letzten zehn Jahren haben sich Stachelmäuse (Acomys-Arten) als robustes Modellsystem zur Untersuchung der Geweberegeneration bei erwachsenen Säugetieren erwiesen, da sie nach Verletzungen komplexe Gewebestrukturen regenerieren können. Ein Team um Kerstin Bartscherer hat in Zusammenarbeit mit dem Labor von Ashley Seifert zelluläre und molekulare Unterschiede in der Wundheilung zwischen erwachsenen Stachelmäusen und Labormäusen (Mus-Arten) verglichen. Das Team identifizierte dabei den ERK-Signalweg als molekularen Schalter zwischen narbenfreier Regeneration und narbenbildender Wundheilung. Die Forschungsergebnisse deuten darauf hin, dass eine Wunde bei erwachsenen Säugetieren durch Feinabstimmung bestimmter zentraler Signalwege so stimuliert werden kann, dass sie narbenfrei regeneriert.

Symbolbild
Computer-generated image
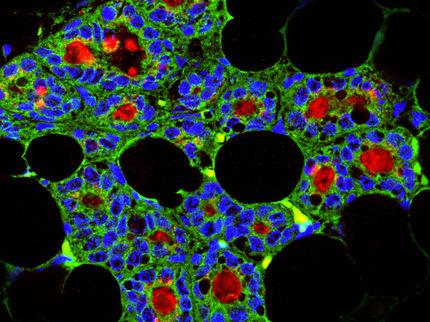
ERK-Aktivatoren – dargereicht in einem mit Wachstumsfaktoren getränkten Mikrokügelchen – stimulieren die endogene Geweberegeneration bei narbenanfälligen Verletzungen von erwachsenen Säugetieren.
Antonio Tomasso/Max Planck Institute for Molecular Biomedicine/Hubrecht Institute

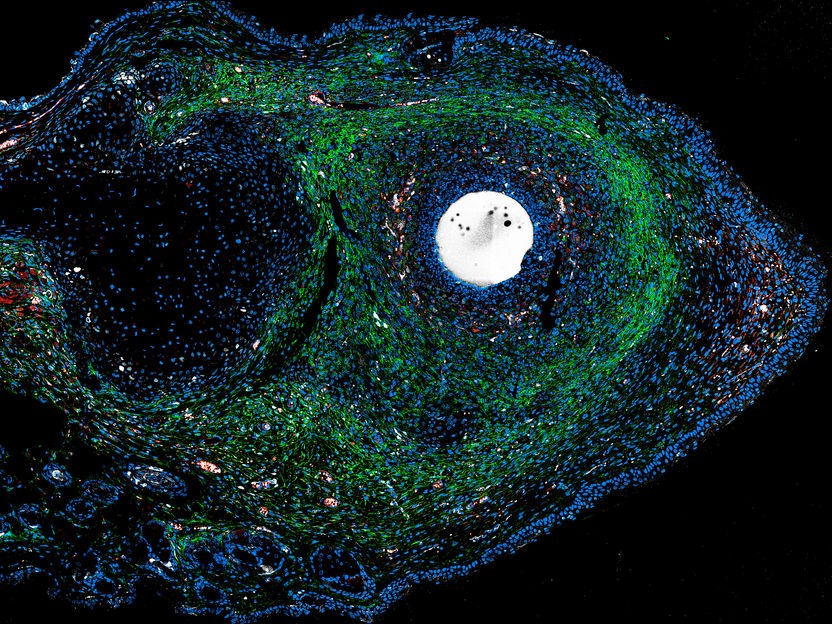
Im Gegensatz zu Säugetieren und dem Mensch sind einige Tierarten wahre Meister der Regeneration: Ein Plattwurm kann in 200 Teile zerlegt werden, von denen jedes wieder zu einem vollständigen Organismus heranwächst, Salamander und Seesterne können Arme nachwachsen lassen, und bei Zebrafischen regenerieren große Teile der Flosse oder des Herzens. Studien an diesen Arten haben bereits wichtige Erkenntnisse über die Mechanismen der Geweberegeneration erbracht. Dennoch bleiben einige Fragen offen: Warum können manche Tiere besser regenerieren als andere? Welche sind die molekularen Schlüsselakteure der Geweberegeneration? Und: Haben Säugetiere, deren Verletzungen normalerweise vernarben, ihre Regenerationsfähigkeit vollständig verloren oder besitzen sie noch latente regenerative Eigenschaften?
In ihren früheren Studien identifizierte das Forschungsteam um Kerstin Bartscherer die Aktivierung des ERK-Signalweg als einen der ersten Prozesse, die in der Regeneration von Plattwürmern in Gang gesetzt werden. Nun wollten die Wissenschaftler:innen herausfinden, ob dieser evolutionär hoch konservierte Signalweg auch bei Säugetieren die Regeneration entfachen kann. Zu diesem Zweck nutzten die Wissenschaftler:innen die Stachelmaus (Acomys-Arten) als Modellorganismus. Stachelmäuse haben bemerkenswerte Regenerationsfähigkeiten, wie Ashley Seifert von der University of Kentucky (USA) 2012 herausfand. Wenn man Stachelmäusen zum Beispiel eine Ohrstanze setzt, regenerieren sich Haarfollikel, Talgdrüsen, Haut und Knorpel vollständig und narbenlos. Die Regenerationsfähigkeit von Stachelmäusen erstreckt sich sogar auf andere Organverletzungen.
"Wir konnten nun zeigen, dass die zelluläre ERK-Aktivität bei erwachsenen Mäusen als molekularer Schalter zwischen Geweberegeneration und -vernarbung fungiert", sagt Antonio Tomasso. Er ist der Erstautor des aktuellen Artikels in Science Advances und war Doktorand im Labor von Kerstin Bartscherer – zunächst am Max-Planck-Institut für molekulare Biomedizin in Münster, dann am Hubrecht Institute in Utrecht (Niederlande).
Vergleichende Studien mit Stachel- und Labormäusen ermöglichten es den Wissenschaftler:innen, die Verletzungsreaktion in verschiedenen Phasen zu analysieren. "Im Labor von Ashely Seifert habe ich die Aktivität von tausenden von Genen auf einmal analysiert, um ein globales Bild der zellulären Funktion zu erstellen, sowohl in Experimenten mit Funktionsverlust als auch mit Funktionsgewinn", sagt Antonio Tomasso.
Nachdem er die FGF- und ErbB2-Rezeptoren als Schlüsselfaktoren für den ERK-Signalweg in Stachelmäusen identifiziert hatte, konnte er die Aktivität des Signalwegs selektiv hemmen, indem er diese Rezeptoren in Acomys blockierte: "Die ERK-Hemmung führte bei Acomys zu einer Verschiebung der Wundreaktion von der narbenlosen Regeneration hin zur Narbenbildung, ähnlich der fibrotischen Wundheilung, die in verletztem Mus-Gewebe beobachtet wird", sagt er.
Noch verblüffender waren die Ergebnisse nach Aktivierung des ERK-Signalwegs in normalerweise narbenbildenden Mus-Arten: “Hier beobachteten wir eine ähnliche Regenerationsreaktion wie bei Stachelmäusen", sagt Antonio Tomasso. "Wir konnten sogar die Regeneration von Haarfollikeln beobachten – eine Eigenschaft, die bei der narbenbildenden Wundheilung fehlt.“
Analysen der ERK-Aktivität auf Einzelzellebene in Zusammenarbeit mit Philip Lijnzaad vom Princess Máxima Center for Pediatric Oncology in Utrecht (Niederlande) ergaben, dass die ERK-Aktivität in Keratinozyten aktiviert wird: "Während der Regeneration wird ERK in Keratinozyten sowie in Zellen des Bindegewebes aktiviert. Keratinozyten sind der dominierende Zelltyp der Epidermis und spielen eine wesentliche Rolle bei der Wundheilung der Haut", sagt Antonio Tamasso. "Diese Daten deuten darauf hin, dass die ERK-Aktivität die Fähigkeit hat, Bindegewebszellen auf ein ansonsten latentes Regenerationsprogramm umzusteuern."
"Interessanterweise beobachteten wir eine anhaltend hohe ERK-Aktivierung nicht nur während der Regeneration von Ohrgewebe, sondern auch während der Regeneration von Haut und nach einem Herzinfarkt in Acomys", sagt Kerstin Bartscherer. "Dies deutet darauf hin, dass eine anhaltend hohe ERK-Aktivität ein allgemeines Merkmal von regenerierendem Gewebe sein könnte.“
"Um die funktionelle Rolle der ERK-Aktivität bei anderen narbenbildenden Verletzungsparadigmen, wie Herzinfarkt oder Rückenmarksverletzung, zu ermitteln, benötigen wir weitere Studien", sagt Kerstin Bartscherer. "Es wäre wichtig zu testen, ob z. B. kleine Moleküle die ERK-Aktivität sicher und lokal aktivieren können, wenn sie in das verletzte Organ verabreicht werden, um dort Regeneration zu fördern." Alle tierexperimentellen Arbeiten wurden entweder an der University of Kentucky oder am Hubrecht Institute nach strengen Richtlinien durchgeführt. Die Arbeit wurde durch eine Förderung des Europäischen Forschungsrats (ERC-StG-IniReg) an Kerstin Bartscherer unterstützt.