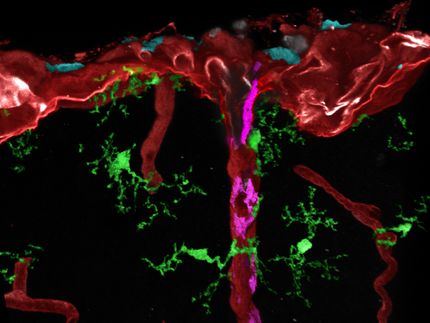
Besser verstehen, wie die Blut-Hirn-Schranke funktioniert
Realitätsnahes in-vitro-Modell entwickelt: Pharmafirma bereits interessiert
Die Barriere zwischen Blut- und Nervensystem anhand von Modellen zu untersuchen, war bisher nicht umfassend möglich oder umständlich. ETH-Forschende haben nun ein realitätsnäheres Modell entwickelt, mit dem auch neue Therapien gegen Hirntumore besser erforscht werden können.

Einem Elfjährigen würde Mario Modena seine Forschung zur Blut-Hirn-Schranke so erklären: «Diese Mauer ist wichtig, weil sie die schlechten Kerle davon abhält, zum Gehirn zu gelangen.» Bei einer Verletzung oder Erkrankung des Gehirns könne die Mauer löchrig werden. Manchmal seien solche Löcher sogar vorteilhaft, weil man zum Beispiel Medizin ins Gehirn bringen muss. «Wir wollen also verstehen, wie man diese Mauer instand hält, sie durchbrechen kann und wieder repariert.»
Computer-generated image
Einem Elfjährigen würde Mario Modena, Postdoc am Bio Engineering Labor der ETH Zürich, seine Forschung zur Blut-Hirn-Schranke, die unser zentrales Nervensystem vor schädlichen Substanzen im Blutkreislauf schützt, so erklären: «Diese Mauer ist wichtig, weil sie die schlechten Kerle davon abhält, zum Gehirn zu gelangen.» Bei einer Verletzung oder Erkrankung des Gehirns könne die Mauer löchrig werden. Manchmal seien solche Löcher sogar vorteilhaft, weil man zum Beispiel Medizin ins Gehirn bringen muss. «Wir wollen also verstehen, wie man diese Mauer instand hält, sie durchbrechen kann und wieder repariert.»
Dies ist auch aus medizinischer Sicht wichtig, da viele Erkrankungen des zentralen Nervensystems mit einer Verletzung der Blut-Hirn-Schranke in Verbindung gebracht werden. Wie genau sie funktioniert, erforschen Wissenschaftler:innen oft an lebenden Tieren. Das ist verhältnismässig teuer, und tierische Zellen liefern nur bedingt Aufschluss über die Funktion des menschlichen Körpers. Ausserdem gibt es Kritiker, die Tierversuche grundsätzlich infrage stellen. Eine Alternative ist die Forschung an kultivierten menschlichen Zellen im Labor.
Zellkommunikation bisher wenig beachtet
Das Problem dieser in-vitro-Modelle: Meist wird die Blut-Hirn-Schranke auf relativ einfache Weise mit Blutgefässwandzellen (Endothelzellen) nachgebaut, was nicht dem komplexen Aufbau im menschlichen Körper entspricht und etwa die Kommunikation zwischen verschiedenen Zelltypen ausser Acht lässt. Zudem sind viele Modelle statisch: Zellen schwimmen gleichsam in einer Lösung, die sich nicht bewegt, womit weder der Faktor Scherspannung, unter der die Zellen im Körper stehen, noch der Faktor Flüssigkeitsfluss in die Beobachtungen einbezogen werden.
In dynamischen in-vitro-Modellen hingegen, die die Flussverhältnisse im Körper nachahmen, kommen meist Pumpen zum Einsatz, die den Versuchsaufbau verkomplizieren. Zu all diesen Herausforderungen gesellt sich auch noch die Problematik der Messung: Es ist kaum möglich, in Echtzeit hochauflösende Bilder von der Strukturveränderung der Barriere und gleichzeitig Zahlen zum elektrischen Widerstand und der damit verbundenen Kompaktheit und Dichtigkeit der Blut-Hirn-Schranke zu liefern.
Mehrere Fliegen mit einer Klappe
Wenn alle diese Herausforderungen Fliegen wären, dann würde die Plattform von Mario Modena sie mit einer Klappe schlagen. Dreieinhalb Jahre haben er und Kolleg:innen unter der Leitung von Andreas Hierlemann ein offen-mikrofluidisches 3D-Blut-Hirn-Schranken-Modell entwickelt.
Für die Barriere hat das Forschungsteam auf einer Plattform jene Zelltypen kombiniert, die auch natürlicherweise die Blut-Hirn-Schranke bilden: mikrovaskuläre Endothelzellen, humane Astrozyten und humane Perizyten. «Damit replizieren wir fast die 3D-Zell-Struktur im menschlichen Körper», sagt Modena. «Aber das wirklich Einzigartige ist, dass wir die Durchlässigkeit der Schranke messen und zugleich mit hochauflösender Zeitraffermikroskopie morphologische Veränderungen der Barriere abbilden können.» Damit beides möglich ist, haben die Forschenden zur Messung der Durchlässigkeit – man misst dazu den elektrischen Widerstand über die Zellbarriere hinweg – komplett durchsichtige Elektroden auf Deckgläsern auf beiden Seiten der Barriere angebracht. Transparente Elektroden haben hier einen entscheidenden Vorteil gegenüber anderen Elektrodenarten, die wegen ihren Drahtstrukturen die Versuchsergebnisse beeinflussen können.
«Komplexität nicht erhöhen»
Um den Flüssigkeitsfluss im Körper zu imitieren, haben die Forschenden die Plattform mit der Flüssigkeit in den Reservoiren auf einer Art Wippe angebracht. Die Schwerkraft erzeugt den Fluss, der wiederum die Scherkräfte auf die Zellen generiert. Andreas Hierlemann erklärt den Vorteil dieses Aufbaus: «Dadurch, dass wir keine Pumpen verwenden, können wir parallel viele Modelle zum Beispiel im Inkubator testen, ohne die Komplexität zu erhöhen.»
In einer Studie, die soeben in der Fachzeitschrift «Advanced Science» veröffentlicht wurde, haben die Forschenden ihr neues in-vitro-Blut-Hirn-Schrankenmodell vorgestellt und getestet. Dazu haben sie die Barriere einem Sauerstoff-Zucker-Mangel ausgesetzt, wie er etwa bei einem Schlaganfall entsteht. «So konnten wir schnell Veränderungen an der Barriere auslösen und das Potenzial der Plattform zeigen», erklärt Modena.
Pharmaunternehmen bereits interessiert
In dieser Studie konnten Modena und seine Kolleg:innen nicht nur zeigen, dass sich ihre neuartige Plattform zur Messung eignet. Sie entdeckten auch, dass der elektrische Widerstand der Barriere zusammenbricht, noch bevor sie sich morphologisch verändert und damit durchlässiger wird. «Das könnte für künftige Forschung interessant sein», sagt Modena. Eine weitere Beobachtung: In Kontrollversuchen mit einem statischen in-vitro-Modell war die Barriere durchlässiger als in Modenas neuer Versuchsanordnung. «Die durch schwerkraftgetriebene Strömung entstandenen Scherkräfte fördern offensichtlich die Bildung einer dichteren Barriereschicht, was bestätigt, wie wichtig Scherkraft in in-vitro-Modellen ist.»
Modena und Hierlemann glauben, dass ihr Modell die Entdeckung von Molekülen, die die Schranke stabilisieren, aber auch von Präparaten und Methoden, um diese zu durchbrechen, erleichtern werde. Dies würde bei der Therapie von Hirntumoren eine Rolle spielen. Ihr Modell könnte aber auch die Zukunft anderer in-vitro-Forschung beeinflussen, sagt Hierlemann: «Der Vorteil unserer Plattform ist, dass man sie sehr einfach an andere Endothelzellen-Modelle anpassen kann und dort mit der Kombination aus Dichtigkeitsmessung und hochauflösender Mikroskopie neue Forschung ermöglicht». Dass die Industrie das Modell für zukunftsträchtig hält, zeigt sich schon jetzt. Ein Pharmaunternehmen ist bereits in Kontakt mit den Forschenden.