Süße Rettung - wie eine Zuckerrohrkrankheit eine neue Ära der Antibiotikaentdeckung einläutet
"Wir glauben, dass dies einer der aufregendsten neuen Antibiotika-Kandidaten seit vielen Jahren ist"
Ein starkes Pflanzentoxin, das auf einzigartige Weise schädliche Bakterien abtötet, hat sich als einer der stärksten neuen Antibiotikakandidaten seit Jahrzehnten erwiesen. Das Antibiotikum mit der Bezeichnung Albicidin wird von dem bakteriellen Pflanzenpathogen Xanthomonas albilineans produziert, das die verheerende Blattverbrühungskrankheit bei Zuckerrohr verursacht. Es wird vermutet, dass der Erreger Albicidin verwendet, um die Pflanze anzugreifen und so seine Ausbreitung zu ermöglichen. Es ist bereits seit einiger Zeit bekannt, dass Albicidin sehr effektiv Bakterien wie E. coli und S. aureus abtötet. Diese Superbakterien, die für ihre zunehmende Resistenz gegen bestehende Antibiotika berüchtigt sind, haben einen dringenden Bedarf an wirksamen neuen Medikamenten ausgelöst.

Eine Skulptur, die eine Albicidin-Bindungstasche, eine Antibiotika-Pille und eine Petrischale darstellt, um eine Bedrohung durch Bakterien zu symbolisieren
Alina Kurokhtina
Trotz seines antibiotischen Potenzials und seiner geringen Toxizität in vorklinischen Experimenten wurde die pharmazeutische Entwicklung von Albicidin behindert, weil die Wissenschaftler nicht genau wussten, wie es mit seinem Ziel, dem bakteriellen Enzym DNA-Gyrase (Gyrase), interagiert. Dieses Enzym bindet sich an die DNA und verdreht sie durch eine Reihe eleganter Bewegungen, ein Prozess, der als Supercoiling bekannt ist und für das reibungslose Funktionieren der Zellen unerlässlich ist.
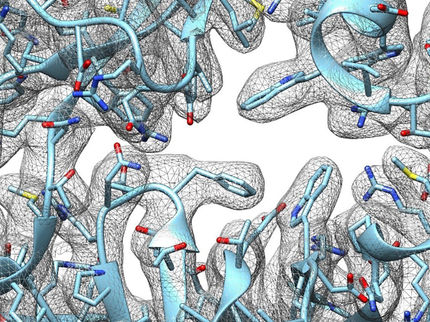
Nun hat die Forschungsgruppe von Dr. Dmitry Ghilarov am John Innes Centre zusammen mit den Labors von Prof. Roderich Süssmuth an der Technischen Universität Berlin und Prof. Jonathan Heddle an der Jagiellonen-Universität in Polen die Fortschritte in der Kryo-Elektronenmikroskopie genutzt, um einen ersten Schnappschuss von Albicidin in Verbindung mit Gyrase zu erhalten.
Dabei zeigte sich, dass Albicidin eine L-Form bildet, die es ihm ermöglicht, sowohl mit der Gyrase als auch mit der DNA auf einzigartige Weise zu interagieren. In diesem Zustand kann sich die Gyrase nicht mehr bewegen, um die DNA-Enden zusammenzuführen. Die Wirkung von Albicidin ist vergleichbar mit einem Schraubenschlüssel, der zwischen zwei Zahnrädern eingeklemmt wird.
Die Art und Weise, wie Albicidin mit der Gyrase interagiert, unterscheidet sich ausreichend von bestehenden Antibiotika, so dass das Molekül und seine Derivate wahrscheinlich gegen viele der derzeitigen antibiotikaresistenten Bakterien wirksam sein werden.
"Es scheint, dass Albicidin aufgrund der Art der Wechselwirkung auf einen wirklich essentiellen Teil des Enzyms abzielt und es für Bakterien schwierig ist, eine Resistenz dagegen zu entwickeln", so Dr. Ghilarov. "Jetzt, da wir die Struktur verstehen, können wir versuchen, diese Bindungstasche weiter auszunutzen und Albicidin weiter zu modifizieren, um seine Wirksamkeit und pharmakologischen Eigenschaften zu verbessern."
Diese Arbeit hat bereits begonnen: Das Team nutzte seine Beobachtungen, um Varianten des Antibiotikums mit verbesserten Eigenschaften chemisch zu synthetisieren. In Tests erwiesen sich diese Varianten als wirksam gegen einige der gefährlichsten bakteriellen Infektionen, die in Krankenhäusern auftreten, darunter Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa und Salmonella typhimurium.
Dr. Ghilarov sagte: "Wir glauben, dass dies einer der aufregendsten neuen Antibiotika-Kandidaten seit vielen Jahren ist. Es hat eine extrem hohe Wirksamkeit in kleinen Konzentrationen und ist hochwirksam gegen pathogene Bakterien - sogar gegen solche, die gegen die weit verbreiteten Antibiotika wie Fluorchinolone resistent sind."
"Dieses Molekül gibt es schon seit Jahrzehnten", fuhr Dr. Ghilarov fort, "jetzt haben Fortschritte in der Kryo-Elektronenmikroskopie es möglich gemacht, die Strukturen selbst der kompliziertesten Protein-DNA-Komplexe zu bestimmen. Die erste Person zu sein, die sieht, wie das Molekül an sein Ziel gebunden ist und wie es funktioniert, ist ein großes Privileg und die beste Belohnung, die man als Wissenschaftler haben kann. Aber diese Arbeit ist eine große Teamleistung, und wir hätten sie ohne unsere europäischen Kollegen nicht geschafft.
Der nächste Schritt für diese Forschung ist die Zusammenarbeit mit akademischen und industriellen Partnern und die Suche nach Finanzmitteln, um die Forschung bis zu klinischen Versuchen am Menschen voranzutreiben. Dies könnte zur Entwicklung einer neuen Klasse von Antibiotika führen, die angesichts der weltweiten Bedrohung durch Antibiotikaresistenzen dringend benötigt werden.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.