Wie Biomoleküle auf UV-Licht reagieren
Laser-Untersuchung zeigt ultraschnelle Dynamik von Proteinmodellen in ihrer natürlichen Umgebung
Ein ausgeklügeltes Experiment liefert neue Einblicke in die ultraschnelle Reaktion von Biomolekülen auf UV-Licht in ihrer natürlichen Umgebung. Das Team um DESY-Wissenschaftler Jochen Küpper untersuchte dazu, was passiert, wenn ein Modellsystem aus einem kleinen organischen Molekül und einem Wassermolekül mit ultraviolettem (UV) Licht bestrahlt wird. Wasser stellt die natürliche Umgebung von Biomolekülen dar. Als Modell für die Biomoleküle diente Indol, der wichtigste UV-Absorber in Proteinen. Das Experiment ist ein wichtiger Schritt auf dem Weg zum Filmen solcher chemischen Reaktionen, wie das Team im Fachblatt „Nature Communications“ berichtet. Küpper ist bei DESY Leitender Wissenschaftler für Controlled Molecule Imaging.
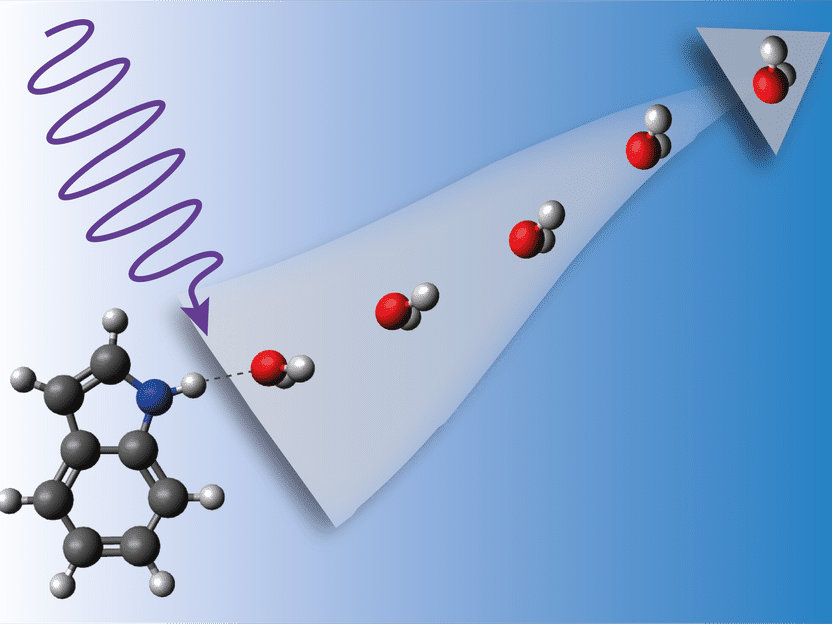
Wenn der Indol-Wasser-Komplex von energiereichem UV-Licht getroffen wird, beginnt er heftig zu vibrieren, bis sich das Wasser ablöst.
Radboud-Universität, Jolijn Onvlee
„In unserem Körper kommen Proteine in der Regel in einer wässrigen Umgebung vor, in der die einzelnen Proteine von Wassermolekülen umgeben sind“, erklärt Hauptautorin Jolijn Onvlee, die mittlerweile als Assistenzprofessorin an der Radboud-Universität in den Niederlanden arbeitet. Die Wechselwirkungen zwischen dem Protein und den umgebenden Lösungsmittelmolekülen (Wasser) beeinflussen unter anderem, wie sich die Proteine falten und damit ihre Funktion. „Wir haben speziell die UV-induzierte ultraschnelle Dynamik von Proteinmodellen in wässriger Umgebung in einem Bottom-up-Ansatz untersucht, wobei wir ein kleines Aggregat eines so genannten Chromophors, also eines lichtabsorbierenden Moleküls, mit einem einzelnen angehängten Wassermolekül verwendet haben“, berichtet Onvlee.
Die als Modellsystem gewählte aromatische Verbindung Indol (C8H7N) ist das Chromophor der Aminosäure Tryptophan und somit in fast allen Proteinen vertreten. Um die Wechselwirkungen zwischen Proteinen und ihrem Lösungsmittel zu erkunden, koppelten die Wissenschaftler Wasser an die Indolmoleküle. Indol kann jedoch mehrere Wassermoleküle binden. Um Verbindungen aus genau einem Indol- und einem Wassermolekül auszuwählen, schickte das Team einen Strahl der Verbindungen durch einen elektrostatischen Filter. Dieser Filter lenkt die Verbindungen mit einem elektrischen Feld unterschiedlich stark ab, je nach Anzahl der angehängten Wassermoleküle. Je nach Flugrichtung finden sich nur die gewünschten Komplexe.
Die Wissenschaftlerinnen und Wissenschaftler schossen dann ultraviolette Laserpulse auf die Indol-Wasser-Verbindungen. Diese absorbierten das UV-Licht, woraufhin eine komplexe Dynamik auf der Zeitskala von Femtosekunden (Billiardstelsekunden) und Pikosekunden (Billionstelsekunden) einsetzte. Mit einem zweiten Laser ließen sich die entstehenden Reaktionsprodukte aufzeichnen. Über die gezielte Änderung der Verzögerung zwischen den beiden Lasern entstanden Schnappschüsse der ultraschnellen Dynamik in verschiedenen Stadien, die den Verlauf der Dynamik wie ein Daumenkino zeigen. „Wenn das UV-Licht auf den Komplex trifft, wechselt das Indol zunächst in einen angeregten Zustand. Sobald diese Energie durch die elektronische Relaxation wieder frei wird, beginnt das System heftig zu vibrieren“, erläutert Küpper. „Dem Indolmolekül ist total heiß.“ Schließlich bricht dann die Bindung zum Wassermolekül.
„Dank der Kombination aus elektrostatischem Deflektor und zeitaufgelöster Bildgebung konnten wir diese ultraschnellen Prozesse jetzt entschlüsseln“, sagt Küpper, der auch Professor an der Universität Hamburg ist. „Letztendlich möchten wir einen 'molekularen Film' in atomarer Auflösung aufnehmen, in dem wir den Weg des Wassers, von dem sich das Indolmolekül trennt, wirklich verfolgen können. Das jetzt präsentierte Ergebnis bringt uns diesem Ziel einen wichtigen Schritt näher.“