Genaue Molekülstruktur eines der wichtigsten Rezeptoren im Immunsystem entschlüsselt
Forschende veröffentlichen die dreidimensionale Struktur des B-Zell-Antigenrezeptors, die neues Licht auf dessen Zusammensetzung wirft
Die Oberfläche von B-Zellen ist gespickt mit Antigenrezeptoren, mit denen sie eindringende Krankheitserreger wie Bakterien und Viren erkennen. Bindet ein solcher B-Zell-Rezeptor an ein Antigen, also eine körperfremde Struktur, aktiviert das die B-Zelle und löst die Produktion von Antikörpern aus. Antikörper sind für uns überlebenswichtig, und schützen bei Infektionen wie COVID-19 vor schwerer Erkrankung. Auch die Schutzwirkung von Impfungen entsteht dadurch, dass sie die Antigenrezeptoren aktivieren und dadurch eine Immunantwort auslösen. Eine internationale Kooperation aus Forschenden vom Exzellenzcluster CIBSS der Universität Freiburg und von der Harvard Medical School/USA haben nun die genaue Molekülstruktur eines B-Zell-Rezeptors vom IgM-Typ veröffentlicht. Ihre Ergebnisse weisen darauf hin, dass der Rezeptor auf der Oberfläche der B-Zelle mit weiteren Rezeptoren interagiert und dessen Signalweiterleitung so gesteuert wird. Die Studie ist in der Fachzeitschrift Nature erschienen.
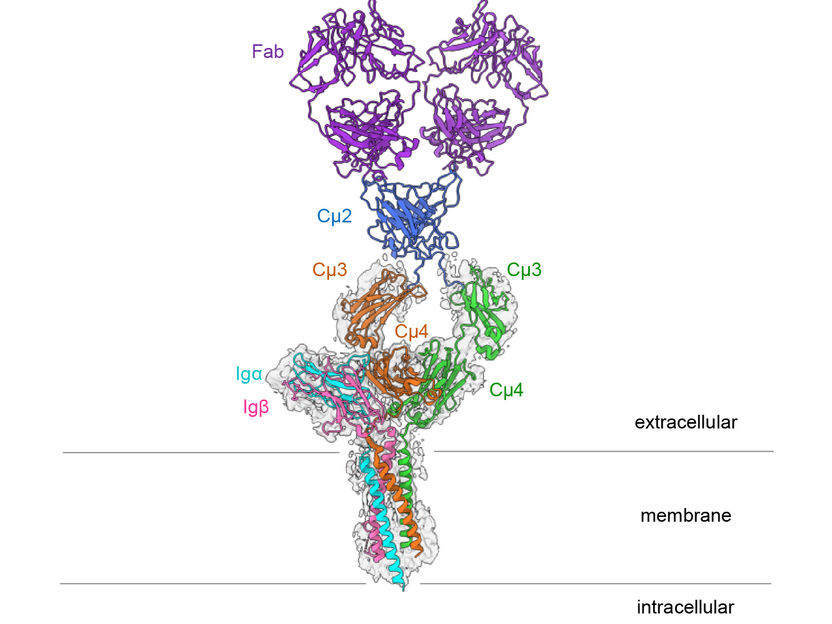
Struktur des IgM-B-Zell-Rezeptors der Maus.
Hao Wu/Harvard Medical School
Verbindung von Signaluntereinheiten mit dem Immunglobulin
Der B-Zell-Antigenrezeptor besteht aus einem an die Zellmembran gebundenen Antikörper und zwei kleineren Proteinen, Ig-alpha und Ig-beta. Diese kleineren Untereinheiten geben Signale in das Innere der Zelle weiter, sobald der B-Zell-Rezeptor einen Krankheitserreger erkennt. „Wie genau diese Signaluntereinheiten mit dem Immunglobulin verbunden sind, war bisher nicht bekannt,“ sagt Prof. Dr. Michael Reth von der Fakultät für Biologie an der Universität Freiburg, der schon seit vielen Jahren an dem Rezeptor forscht und seine Signaluntereinheiten ursprünglich entdeckt hatte. Er ist Mitglied im Exzellenzcluster CIBSS – Centre for Integrative Biological Signalling Studies und Ko-direktor des Exzellenzclusters BIOSS, und hat die Studie gemeinsam mit der Strukturbiologin Prof. Hao Wu, Ph.D. von der Harvard Medical School, USA, geleitet. „Lange gab es keine technischen Möglichkeiten die genaue Struktur von Membranproteinen zu untersuchen. Mit der Kryo-Elektronenmikroskopie konnten wir nun ein hochauflösendes Bild des B-Zell-Rezeptors erstellen,“ so Reth.
Bei der Kryo-Elektronenmikroskopie kühlt man die zu untersuchende Probe sehr schnell auf minus 183 °C herunter. Dadurch ist die natürliche Bewegung der Moleküle reduziert und es bilden sich keine Eiskristalle, die die Proteinstruktur zerstören. So lassen sich Auflösungen erreichen, die um ein Vielfaches höher sind als bei anderen elektronenmikroskopischen Methoden. In ihrer aktuellen Studie erreichten die Forschenden eine Auflösung von 3,3 Ångström, was der Breite von nur wenigen Atomen entspricht. Dafür kombinierten sie hunderttausende Aufnahmen des gesamten Rezeptors mit denen einer verkürzten Version, der zwei flexible Regionen fehlten. Daraus berechneten sie im Computer die komplette dreidimensionale Struktur des B-Zell-Rezeptors.
Symmetrischer, membrangebundener Antikörper bindet nur auf einer Seite
Besonders auffällig an der dreidimensionalen Struktur ist, dass der symmetrische membrangebundene Antikörper nur auf einer Seite an Ig-alpha und Ig-beta bindet und somit einen asymmetrischen Komplex bildet. Diese Asymmetrie ähnelt der der des T-Zell-Rezeptors, ein anderer wichtiger Immunrezeptor, dessen Struktur im Jahr 2019 erstmalig entschlüsselt wurde. „Es ist erstaunlich, dass beide Antigenrezeptor-Typen asymmetrische Komplex bilden,“ erklärt Reth. „Wir schließen daraus, dass die jetzt aufgeklärte Struktur Teil eines größeren Rezeptorkomplexes ist, und noch mit weiteren Molekülen auf der B-Zell-Oberfläche interagiert.“
Solche größeren Strukturen, die durch weniger starke Kräfte zusammengehalten werden, lassen sich mit Techniken wie der Kryo-Elektronenmikroskopie bisher noch nicht untersuchen. Die neu veröffentlichte Molekülstruktur liefert aber noch weitere Hinweise, die für eine solche Interaktion mit weiteren Molekülen sprechen: Sie zeigt, dass die Außenseite des B-Zell-Rezeptors konservierte Aminosäuren enthält. Als konserviert bezeichnet man die Aminosäuren, die sich im Lauf der Evolution kaum verändern, und daher in unterschiedlichen Lebewesen in deren Antigenrezeptoren identisch sind. „Das Vorhandensein von konservierten Aminosäuren, die nach außen gerichtet sind, spricht für weitere Bindungspartner des IgM-B-Zell-Rezeptors,“ so Reth. „Das bedeutet, wir kennen bisher nur einen Teil der Maschine – und wollen nun die weiteren Bausteine identifizieren und herausfinden, wie sie die Signalwirkung des Rezeptors beeinflussen.“
Diese anderen Bausteine könnten erklären, wie der Rezeptor im Normalfall ruhig gehalten und nur dann aktiviert wird, wenn er an ein Antigen bindet. „Das wird eine der nächsten großen Aufgaben bei der Erforschung der adaptiven Immunität sein,“ fasst Reth zusammen. „Ein besseres Verständnis der B-Zell-Aktivierung könnte auch dabei helfen, die Entwicklung von Impfstoffen noch weiter zu verbessern, oder die Bildung von Lymphomen zu verstehen, bei denen der B-Zell-Rezeptor unkontrolliert aktiviert ist.“