Hippo-Signalweg macht Zellen wieder glücklich: Möglichkeiten zur Verjüngung von Stammzellen gefunden?
Fitnessprogramm für Blutstammzellen – TAZ-Protein schützt vor alternsbedingtem Funktionsverlust
Zum Schutz vor Infektionen ist ein gut funktionierendes Immunsystem unerlässlich. Mit zunehmendem Alter nimmt die Funktion des Immunsystems jedoch ab, was auch auf alternsbedingte Schäden in hämatopoetischen Stammzellen zurückzuführen ist. Forschende des Leibniz-Instituts für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena haben nun herausgefunden, wie der Co-Aktivator des Hippo-Signalwegs, das TAZ-Protein, die Blutstammzellen vor dem Altern schützen und somit vor einem Funktionsverlust bewahren kann. Darüber hinaus altern die Blutstammzellen sehr heterogen. Neben alten Zellen findet man auch "jugendliche" Zellen, wenn der Schutzmechanismus effektiv gewirkt hat.
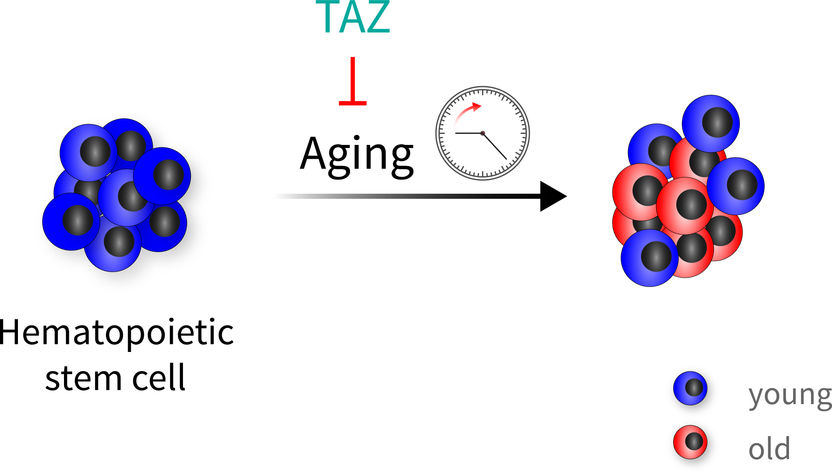
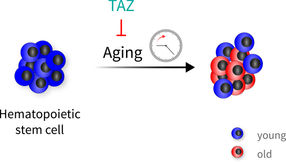
Blutstammzellen altern sehr heterogen. Das TAZ-Protein, ein Co-Aktivator des Hippo-Signalwegs, kann die Blutstammzellen vor dem Altern schützen. Neben alten Zellen findet man daher auch "jugendliche" Zellen, wenn dieser Schutzmechanismus gewirkt hat.
FLI / Björn von Eyss

Symbolbild
Computer generated picture

Unser Blut wird immer wieder neu aus hämatopoetischen Stammzellen gebildet. Mit zunehmendem Alter verlieren die Blutstammzellen jedoch ihre Funktion und ihr Regenerationspotenzial lässt nach. Bei älteren Menschen tritt noch ein weiteres Problem bei der Blutbildung (Hämatopoese) auf: sie bilden weniger Lymphozyten, so dass sie Infektionen oft nicht mehr so gut bewältigen können und nach einer Impfung meist keine hoch wirksame Immunantwort zeigen.
Es gibt bereits zahlreiche Hinweise darauf, dass die beschriebenen Defizite im Alter vor allem auf alternsbedingte Schäden in den Blutstammzellen zurückzuführen sind. Wie es zu diesen Schäden kommt und ob es Schutzmechanismen gibt, wie sich Blutstammzellen möglicherweise davor schützen können, ist bisher nicht bekannt. Forschende vom Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena, dem Universitätsklinikum Jena, der Harvard University in Cambridge, USA und dem ERIBA in Groningen, Niederlande, haben mit Hilfe neuartiger Analysemethoden auf Einzelzellebene nun in einer kürzlich in „Nature Communications“ erschienenen Studie genauer untersucht, was beim Alternsprozess in hämatopoetischen Stammzellen passiert und welche Rolle das TAZ-Protein dabei spielt.
Hippo-Signalweg macht Zellen wieder glücklich
Der erwachsene Körper setzt jeden Tag Milliarden von Zellen um; im Zuge dessen werden ununterbrochen bestehende Zellen durch „neue“ Zellen ersetzt. „Das Aufrechterhalten der Balance zwischen Zellteilung, Zelldifferenzierung und Zelltod ist dabei ungeheuer wichtig, denn bereits kleinste Dysbalancen stören dieses Gleichgewicht und tragen früher oder später zur Entstehung von Krebs bei oder können zu vorzeitigem Altern führen“, erläutert Dr. Björn von Eyss, Leiter der Forschungsgruppe „Transkriptionelle Kontrolle der Gewebshomöostase“ am FLI.
Bei der Regeneration von Geweben, aber auch bei der Krebsentstehung, spielt der Hippo-Signalweg eine zentrale Rolle. Er kontrolliert die Zellteilung in den Organen und Geweben und sorgt dafür, dass diese die richtige Größe und Form annehmen und auch beibehalten. „Der Hippo-Signalweg schützt die Zellen im Körper. Er macht sie quasi wieder glücklich, wenn sie zellulärem Stress ausgesetzt sind,“ ergänzt Dr. von Eyss. „Auch im Alter sind viele Gene des Hippo-Signalweges hochreguliert, doch bisher weiß man nur wenig, welche Rolle diese Prozesse beim Altern spielen.“
YAP/TAZ-Aktivität für die Regeneration von Geweben wichtig
Der Hippo-Signalweg hemmt die Aktivität von Proteinen, so zum Beispiel von YAP (Yes-associated Protein) und TAZ (Transcriptional Co-Activator with PDZ-Binding Motif). Dies sind Proteine, die das Umschreiben bestimmter Gene auf der DNA in die Boten-RNA (mRNA) steuern – ein Prozess, der Transkription genannt wird. Jüngste Studien zeigten, dass YAP und TAZ auch für die Regeneration von Geweben im Darm oder in der Leber unerlässlich sind und den Zellen durch Umprogrammierung in einen primitiveren Zustand helfen, besser mit dem Stress durch den Gewebeschaden umzugehen.
„Angesichts ihrer wichtigen Rolle bei der Regeneration analysierten wir in den Blutstammzellen von jungen und alten Mäusen die Genexpression und prüften, welche Gene mit dem Altern hoch- beziehungsweise herunterreguliert werden,“ berichtet KyungMok Kim, Doktorand im Labor von Dr. Björn von Eyss. „Wir fanden heraus, dass sich mit dem Altern die Gene in den Zellen verändern. In den Zellen der alten Mäuse war das TAZ-Protein als Co-Aktivator des Hippo-Signalwegs stärker induziert, und es wurden mehrere hundert Gene hochreguliert.“ Die auffälligste alternsabhängige Veränderung trat beim Clca3a1-Gen auf, so dass die Forscher für ihre weiteren Studien dieses TAZ-induzierte Gen als sensitiven Marker verwendeten.
Interessanterweise ist das Genprodukt CLCA3A1 ein Protein, dass sich auf der Oberfläche von Zellen befindet und durch das TAZ-Protein induziert wird. Mit Hilfe von Antikörpern gegen CLCA3A1 gelang es so der Forschungsgruppe um von Eyss, eine spezifische Population von Zellen zu identifizieren, die hohe oder niedrige Mengen an CLCA3A1 aufwiesen. Durch die Anwendung spezieller Einzelzellmethoden, wie single-cell RNA-Seq oder single-cell ATAC- Seq in der Core Facility „Sequencing“ des Instituts, war es zudem möglich, die TAZ-Aktivität auf zellulärer Ebene in jeder einzelnen Zelle zu betrachten und in vivo direkt zu verfolgen.
Blutstammzellen altern heterogen
Die Forschenden fanden damit heraus, dass Blutstammzellen nicht einheitlich altern. Sie sind vielmehr sehr heterogen und weisen gemischte Populationen auf. So konnten aus alten Mäusen Subpopulationen isoliert werden, in denen die Zellen überwiegend alt waren, aber auch Populationen, in denen sich die Zellen in einem "jugendähnlichen" Zustand befanden. Auch die Genexpressionsmuster dieser Zellen ähnelten eher denen von jungen Blutstammzellen. Das ist ein Indiz dafür, dass TAZ in gewissem Maße dem allmählichen Verlust der Stammzellfunktion entgegenwirken und die Blutstammzellen schützen kann, indem es sie quasi verjüngt. Folglich führte die genetische Herunterregulierung von TAZ in alten Blutstammzellen zu einem drastischen Versagen bei der Wiederherstellung des Blutsystems nach einer Transplantation dieser Blutstammzellen.
Möglichkeiten zur Verjüngung von Stammzellen gefunden?
„Unsere neuen Erkenntnisse eröffnen völlig neue Perspektiven, um Stammzellen wieder fitter zu machen“, fasst KyungMok Kim die Forschungsergebnisse der Studie zusammen. „Wenn es uns zum einen gelingt, die alten von den jüngeren Blutstammzellen gezielt herauszufiltern und aus dem Körper zu isolieren, dann könnte man damit das Immunsystem pushen und wieder deutlich aktiver machen“. Dieser Ansatz zur Verjüngung von Stammzellen soll in einem Anschlussprojekt, gefördert durch die Leibniz-Gemeinschaft, genauer untersucht werden.
„Zum anderen könnten unsere Ergebnisse dabei helfen, besser zu verstehen, warum wir so unterschiedlich altern und warum es Unterschiede zwischen dem biologischen und dem chronologischen Alter gibt,“ ergänzt Dr. Björn von Eyss. Obwohl die Zellen chronologisch alle gleich alt sind, altern sie dennoch unterschiedlich.
Wenn die epigenetische Uhr aber nicht in allen Zellen des Körpers gleich tickt, könnte das die zustande kommenden Unterschiede im biologischen Alter der Zellen erklären. Die Epigenetik beschreibt chemische Markierungen am Erbgut, die zwar nicht die Abfolge der DNA-Bausteine beeinflussen, aber bestimmen, wie und welche Gene abgelesen werden. Auch diese Art von Informationen wird mit weitergegeben, wenn sich Zellen teilen und mit dem Altern verändern. Die Heterogenität der Zellen - wie in dieser Studie bei den Blutstammzellen gezeigt - könnte möglicherweise aus unterschiedlichen epigenetischen Markierungen in den Subpopulationen resultieren. Das funktionelle Verständnis dieser Markierungen in den Blutstammzellen könnte somit Hinweise auf den Ablauf des Alterns und damit verbundene Erkrankungen geben.
Originalveröffentlichung
Taz protects hematopoietic stem cells from an aging-dependent decrease in PU.1 activity. Kim KM, Mura-Meszaros A, Tollot M, Krishnan MS, Gründl M, Neubert L, Groth M, Rodriguez-Fraticelli A, Svendsen AF, Campaner S, Andreas N, Kamradt T, Hoffmann S, Camargo FD, Heidel FH, Bystrykh LV, de Haan G, von Eyss B. Nat Commun. 2022, 13(1), 5187