Aggressive Krebszellen schachmatt setzen
Eine erstaunliche Beobachtung
Trotz Chemo- oder Strahlentherapie überleben BRCA1/2-mutierte Tumorzellen oft. Es gelingt ihnen, therapiebedingte DNA-Schäden zu reparieren. Wie eine Blockade des Proteins TSG101 sie daran hindert, darüber berichtet ein Team um Claus Scheidereit vom Max Delbrück Center nun im „EMBO Journal“.
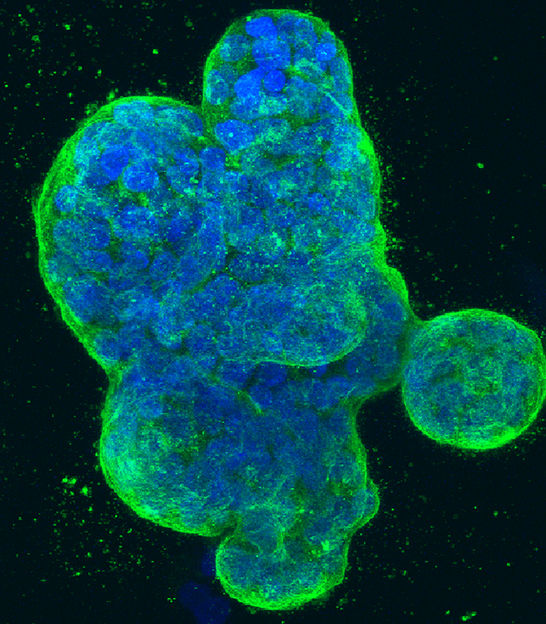
Dreidimensionale Kultur menschlicher Brustkrebszellen, mit blau gefärbter DNA und einem grün gefärbten Protein in der Zelloberflächenmembran.
NCI Center for Cancer Research, National Cancer Institute, National Institutes of Health , CC BY-NC 2.0 (https://creativecommons.org/licenses/by-nc/2.0/)
Um Einzel- oder Doppelstrangbrüche an der DNA zu beheben, die durch Umweltgifte, Chemotherapien oder ionisierende Strahlung entstanden sind, hat jede Zelle einen „Werkzeugkasten“ parat – mit zwei unterschiedlichen Tools. Das eine besteht aus den Reparaturgenen BRCA1 und BRCA2. Das andere ist ein Enzym namens PARP1, eine Poly-(ADP-Ribose)-Polymerase. Sowohl gesunde als auch entartete Zellen nutzen diese Werkzeuge. Sie bewirken im Endeffekt das gleiche und können sich gegenseitig ersetzen. Gelingt die DNA-Reparatur nicht, weil die Schäden zu massiv sind, leitet die Zelle ihr Selbstmordprogramm ein – die Apoptose – und zerstört sich selbst. Darauf zielen Krebsbehandlungen ab.
Menschen, die Träger von Genmutationen an BRCA1 und/oder BRCA2 sind, haben ein sehr hohes Risiko für bestimmte Tumorarten, allen voran für Brust-, Eierstock- und Prostatakrebs. Ihnen fehlt eines dieser Werkzeuge – deshalb entstehen öfter Krebszellen. Zwar haben auch diese Tumorzellen nur ein Tool zur Verfügung, um ihr Überleben zu sichern: PARP1. Dennoch sind gerade BRCA1/2 assoziierte Tumore meist sehr aggressiv und schwer behandelbar. Forschende um Professor Claus Scheidereit vom Max Delbrück Center und Letztautor der Studie, haben sich deshalb den Signalweg, der das Enzym PARP1 aktiviert, genau angesehen. Dabei entdeckten sie einen Weg, dieses Werkzeug gezielt unbrauchbar zu machen.
Um nach DNA-Schäden die Apoptose zu verhindern, springt der NF-κB-Signalweg an. Er initiiert im Zellkern das Ablesen von Genen, die letztlich PARP1 aktivieren, sodass die Zelle den Schaden beheben kann. Ahmet Tufan, Erstautor der Studie, screente zusammen mit Katina Lazarow vom Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) das gesamte menschliche Erbgut nach Genen, die diesen Signalweg steuern, indem er Gen für Gen einzeln ausschaltete. Dazu schleuste er zunächst ein „Mess-Gen“ in das Genom ein, das den Bauplan für ein fluoreszierendes Protein liefert. „Wenige Stunden nachdem das zugegebene Chemotherapeutikum Etoposid DNA-Schäden verursacht hat, leuchten die Zellen grün auf, weil NF-κB aktiviert wird“, erklärt Tufan. Sehr, sehr viele der Proben für die 20.000 Gene leuchteten – einige aber nicht. Denn in diesen war offenbar ein Gen ausgeschaltet, das für den Signalweg wichtig war.
Die Reparatur mit PARP1 verhindern
Doch welches? Infrage kamen ein paar Tausend Kandidatengene – schließlich werden über den NF-κB-Signalweg eine ganze Reihe von Zellfunktionen gesteuert, etwa die Immunantwort. „Bioinformatisch haben wir zunächst die aussortiert, die reguläre Aufgaben im Zellhaushalt erfüllen und die verbleibenden 500 Gene der gleichen Prozedur noch einmal unterzogen.“ Das Team setzte erneut Etoposid ein, um DNA-Schäden hervorzurufen. „Jeweils parallel haben wir das Zytokin TNF-alpha genutzt, was auch diesen Signalweg aktiviert, aber nur bei Entzündungen ins Spiel kommt“, sagt Claus Scheidereit.
Nur eine kleine Gruppe von Genen blieb übrig: Von einigen wussten die Forschenden bereits, dass sie zum Signalweg gehören, von anderen nicht. Welches war das Entscheidende? Ahmet Tufan durchforstete mit Hilfe von Algorithmen diverse Datenbanken nach Hinweisen. Wo wurden Produkte dieser Gene zusammen mit anderen zitiert? Gab es Publikationen, laut denen die fraglichen Proteine Komplexe mit weiteren bilden? Auch die laboreigenen Datenbanken hat das Team durchkämmt. Und plötzlich war alles klar: Das gesuchte Protein war TSG101. Kein Unbekannter, denn es hat etliche Aufgaben in der Zelle. Aber in diesem speziellen Fall bindet es an PARP1, sobald das Enzym am Schadensort angedockt hat. Und erst dann – und nur dann! – kann PARP1 selbst aktiv werden.
„PARP1 ist wie ein geladener Revolver“, sagt Scheidereit. „Egal, ob man nur an den Zellen kratzt, Scherkräfte darauf wirken lässt oder sie gänzlich zertrümmert: PARP1 wird aktiviert. Doch wenn kein TSG101 in der Zelle ist, funktioniert das nicht. Es fehlt quasi der Abzug.“ Das Geschehen konnten die Forschenden mittels eines fluoreszenzmarkierten PARP1 live unter dem Mikroskop verfolgen: Wenige Sekunden nachdem sie mit einem Laser winzige Löcher in den Zellkern gebrannt hatten, leuchteten die Zellen grün auf. PARP1 strömte von allen Seiten in den Zellkern ein und band an die defekten DNA-Stellen. Nach einigen Minuten schwächte sich das Leuchten wieder ab.
Gezieltere Brustkrebstherapie entwickeln
„PARP1 modifiziert sich selbst, lockt weitere Hilfsproteine an, welche die Reparatur vollziehen und fällt anschließend wieder ab“, erklärt Scheidereit. War das TSG101-Gen aber ausgeschaltet, strömte PARP1 zwar genauso schnell in die DNA-Schäden im Zellkern ein – aber das grüne Leuchten blieb bestehen. PARP1 gelang es nicht, sich wieder von der DNA lösen. „Unter all den Beobachtungen während der Live-Cell-Imaging-Experimente, die ich gemacht habe, war das die erstaunlichste: dass PARP1 an DNA-Schäden mit TSG101-freien Zellen tatsächlich gefangen wurde“, sagt Ahmet Tufan.
„Mit dieser Arbeit haben wir gezeigt, dass PARP-Inhibitoren und das Wegnehmen von TSG101 den gleichen Effekt haben“, betont Scheidereit. An verschiedenen Brustkrebszelllinien konnten die Forschenden zudem im Labor zeigen, dass Zellen, bei denen das TSG101-Gen ausgeschaltet war, nach einer Chemo rasch absterben. Am schnellsten kapitulierten jedoch diejenigen, die Mutationen an BRCA1 aufwiesen. Ihnen stand nun kein Werkzeug zur DNA-Reparatur mehr zur Verfügung.
PARP-Inhibitoren werden bereits seit einigen Jahren im Rahmen bestimmter Tumortherapien eingesetzt – etwa bei Brustkrebs mit nachgewiesener BRCA-Mutation. „Leider gibt es bisher keinen einzigen Hemmer, der wirklich selektiv für PARP1 ist, denn es gibt eine ganze Gruppe von PARP-Genen. Aufgrund unserer Ergebnisse kann man nun aber gezielt nach Wirkstoffen suchen, welche die Bindung von TSG101 an PARP1 blockieren“, sagt Claus Scheidereit. Damit ist die Studie eine mögliche Grundlage für die zukünftige Entwicklung hochwirksamer und gezielterer Therapien für BRCA1/2 assoziierte Tumorerkrankungen.