Vogel-Enzym eröffnet Wege zu neuen Therapien
Wissenschaftler statten Zellen mit einem "nicht-kanonischen" Weg zur Herstellung ihrer eigenen Medikamente aus
Dem seltenen Schopfibis verdanken wir einen Hinweis, der unserem Körper eines Tages helfen könnte, bessere Medikamente herzustellen.

Dank des seltenen Schopfibis gibt es einen Hinweis, der unserem Körper eines Tages helfen könnte, bessere Medikamente herzustellen (symbolisches Bild).
Computer generated picture
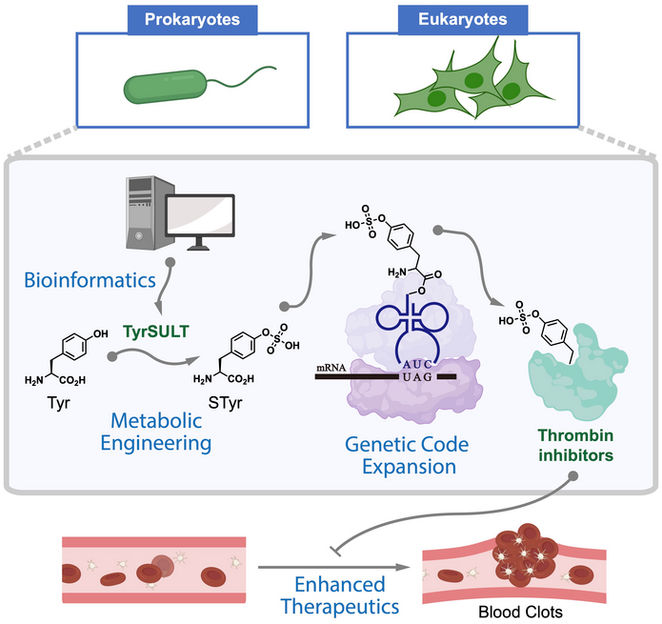
Eine Grafik zeigt, wie Chemiker der Rice University einen seltenen genetischen Weg nutzten, um Zellen, die als Medikamentenfabriken dienen, metabolisch so zu verändern, dass sie Thrombin-Inhibitoren herstellen, die Blutgerinnsel auflösen. Die Studie begann mit einer bioinformatischen Untersuchung, bei der der Schlüssel in einem Schopfibis gefunden wurde.
Xiao Lab/Rice University
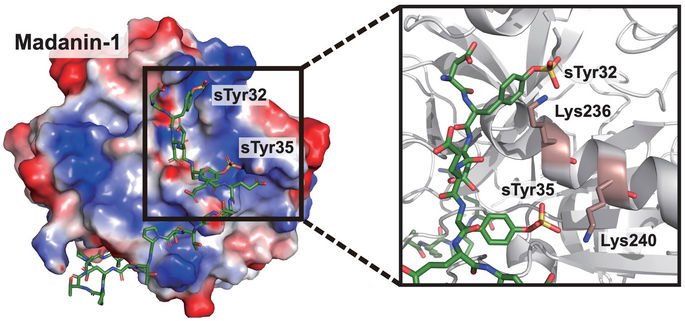
Wissenschaftler der Rice University haben Zellen entwickelt, die therapeutische Proteine, insbesondere einen Thrombin-Inhibitor, exprimieren können. Der Schlüssel dazu ist die ortsspezifische Einfügung von Sulfotyrosin (sTyr), einer Mutante der Standard-Aminosäure Tyrosin, die natürlicherweise nur beim Schopfibis vorkommt.
Xiao Lab/Rice University

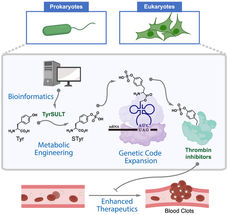
Die Vogelart ist die einzige, von der bekannt ist, dass sie auf natürliche Weise ein Enzym produziert, das in der Lage ist, eine nicht-kanonische Aminosäure zu erzeugen, d. h. eine, die nicht zu den 20 Aminosäuren gehört, die zur Kodierung der meisten Proteine erforderlich sind.
Dass es existiert - eine Entdeckung, die durch den rechnerischen Vergleich von Genomdatenbanken gemacht wurde - beweist, dass es möglich ist, dass dieses Enzym im Kontext lebender Zellen funktioniert, auch wenn die Wissenschaftler nicht wissen, was es für den Vogel tut.
Aber sie haben eine ziemlich gute Vorstellung davon, was es für uns tun könnte.
Eine neue Studie des Chemikers Han Xiao, des theoretischen Physikers Peter Wolynes und ihrer Kollegen von der Rice University zeigt, dass die Aminosäure Sulfotyrosin (sTyr), eine Mutante der Standard-Aminosäure Tyrosin, ein wichtiger Baustein für die Programmierung lebender Zellen ist, die therapeutische Proteine produzieren. Sie könnte es Zellen ermöglichen, als Sensoren zu dienen, die ihre Umgebung überwachen und mit der notwendigen Behandlung reagieren.
Um die Fähigkeit des Ibis, sTyr zu synthetisieren und in Proteine einzubauen, nachzuahmen, muss die DNA einer Zelle mit einem mutierten Codon verändert werden, das wiederum das Transferase-Enzym, die Sulfotransferase 1C1, des Vogels erzeugt. Dieses katalysiert die Bildung von sTyr, einer wesentlichen Erkennungseinheit in einer Vielzahl biomolekularer Interaktionen.
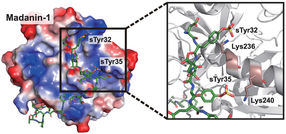
In der Proof-of-Concept-Studie wurden zum ersten Mal Säugetierzellen hergestellt, die sTyr synthetisieren. In einem Experiment stellte das Xiao-Labor Zellen her, die die Wirksamkeit von Thrombin-Inhibitoren, Antikoagulanzien zur Verhinderung der Blutgerinnung, verstärkten.
Die Studie erscheint in Nature Communications.
"In der Natur bestehen die meisten unserer Arten aus 20 kanonischen Bausteinen", so Xiao. "Wenn man einen zusätzlichen Baustein hinzufügen möchte, muss man sich überlegen, wie man ihn herstellen kann. Wir haben dieses Problem gelöst: Wir können die Zelle bitten, ihn herzustellen.
"Aber dann brauchen wir eine Translationsmaschinerie, die ihn erkennt. Und ein spezielles Codon, um diesen neuen Baustein zu kodieren", sagte er. "Mit dieser Studie haben wir alle drei Anforderungen erfüllt".
Xiao erhielt 2019 ein Stipendium der National Institutes of Health, um herauszufinden, ob Zellen so programmiert werden können, dass sie Substanzen mit zusätzlichen Aminosäuren herstellen. Die neue Studie demonstriert den dramatischen Fortschritt des Labors.
Bisher fütterten Wissenschaftler die Zellen mit chemisch synthetisierten, nicht-kanonischen Aminosäuren. Xiao zufolge ist es weitaus effizienter, die Zelle die Arbeit machen zu lassen, doch dazu ist die Entdeckung eines neuen Transferase-Enzyms mit Tyrosin-Taschen erforderlich, das Sulfat binden kann. Diese Schlüssel-Schloss-Kombination könnte dann als Grundlage für eine Vielzahl von Katalysatoren verwendet werden.
"Mit dieser neuen Strategie zur Veränderung von Proteinen können wir die Struktur und die Funktion eines Proteins völlig verändern", sagte er. "Bei unseren Modellen für Thrombininhibitoren haben wir gezeigt, dass ein unnatürlicher Baustein das Medikament viel wirksamer machen kann."
Es war einen Blick wert, um zu sehen, ob die Natur ihnen bei der Suche nach einem nützlichen Codon zuvorgekommen war. Zu diesem Zweck zog Xiao Wolynes, den Co-Direktor des Zentrums für Theoretische Biologische Physik, hinzu, dessen Labor Genomdatenbanken verglich und die Sulfotransferase 1C1 beim Ibis fand.
Das Xiao-Labor verwendete ein mutiertes bernsteinfarbenes Stoppcodon, eine Dreiergruppe aus Uracil, Adenin und Guanin, um die gewünschte Sulfotransferase zu kodieren, was zu einer völlig autonomen Säugetierzelllinie führte, die in der Lage ist, sTyr zu biosynthetisieren und mit großer Präzision in Proteine einzubauen.
"Wir hatten Glück", sagte Xiao. "Der Ibis ist die einzige Spezies, die dies kann, was wir durch eine Sequenzähnlichkeitssuche in den Genominformationen herausgefunden haben. Daraufhin haben wir gefragt, ob sie herausfinden können, warum dieses Enzym Tyrosin erkennt, unsere menschliche Sulfotransferase aber nicht."
Das Wolynes-Team setzte AlphaFold2 ein, ein von Alphabet/Google's DeepMind entwickeltes Programm für künstliche Intelligenz, das die Struktur von Proteinen vorhersagt.
Die Forscher erwarten, dass sie die Kombination aus Bioinformatik und computergestütztem Screening nutzen werden, um eine Bibliothek biosynthetischer nicht-kanonischer Aminosäuren zu erstellen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.