Von der Wundheilung zur Regeneration
Heidelberger Forscher weisen nach, wie auf molekularer Ebene Verletzungen in Regenerationssignale umgewandelt werden
Das Phänomen der Regeneration wurde vor mehr als 200 Jahren beim Süßwasserpolypen hydra entdeckt. Weitgehend unklar blieb aber, wie die geordnete Neubildung von zerstörtem Gewebe oder verlorenen Organen aktiviert wird. Ein interdisziplinäres Forschungsteam an der Universität Heidelberg konnte nun mit seinen Untersuchungen an Hydra zeigen, auf welche Weise bei einer Verletzung freiwerdende Signale für die Wundheilung in spezifische Signale für Musterbildung und Zelldifferenzierung überführt werden. Wesentliche Bestandteile hier sind Mitogen-aktivierte Proteinkinasen (MAPK) und der Wnt-Signalweg – molekulare Mechanismen, die in der Evolution weitgehend unverändert erhalten wurden.
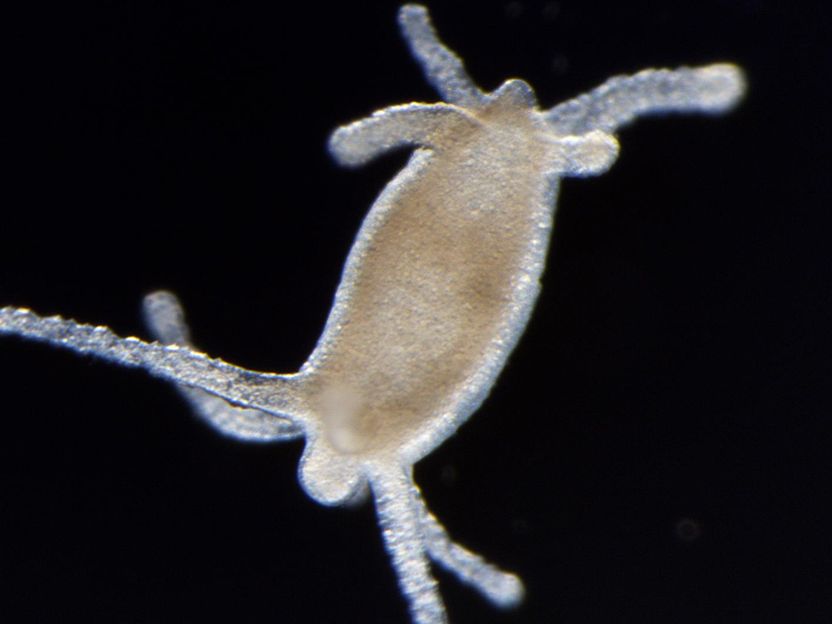
Das Bild zeigt ein Hydra-Regenerat, bei dem zuvor Kopf und Fuß entfernt wurden, wobei die Regeneration mit rekombinantem Wnt dazu geführt hat, dass sich anstelle eines regenerierten Fußes ein zweiter Kopf mit Tentakeln gebildet hat.
Anja Tursch und Thomas W. Holstein (Universität Heidelberg)
Die Fähigkeit zur Regeneration ist bei Tieren sehr unterschiedlich ausgeprägt. Während die meisten Säugetiere und Wirbeltiere nur eine sehr begrenzte Regenerationsfähigkeit besitzen, können einfache und in der Evolution früh entstandene Tiere wie Nesseltiere und Planarien ihren gesamten Körper regenerieren. In allen Fällen beginnt dieser Vorgang mit der Wundheilung. An der Verletzungsstelle proliferieren die Zellen; sie bilden eine undifferenzierte Verdichtung – ein Blastem, aus dem zerstörte Strukturen geordnet neu gebildet werden. Dabei werden genetische Prozesse aktiviert, die auch die Embryonalentwicklung kontrollieren. Welche molekularen Mechanismen hier wirken, hat das Forschungsteam unter der Leitung von Prof. Dr. Thomas W. Holstein am Süßwasserpolypen Hydra untersucht, um so die Aktivierung der Regeneration in seinen Grundzügen zu verstehen.
Kernstück der Untersuchungen ist die Doktorarbeit von Anja Tursch. Sie hat das Schlüsselexperiment wiederholt, mit dem der Genfer Naturforscher Abraham Trembley (1710 bis 1784) das Phänomen der Regeneration entdeckt hat. Dazu wird der Polyp Hydra in zwei Hälften geteilt, wobei in der oberen Hälfte ein neuer „Kopf“ und in der unteren Hälfte ein neuer „Fuß“ regeneriert – an der Schnittfläche in der Mitte können also aus ein- und demselben Gewebe ganz unterschiedliche Körperteile entstehen. Aufbauend auf ihren früheren Arbeiten zur Regeneration bei Hydra haben die Wissenschaftlerinnen und Wissenschaftler am Centre for Organismal Studies (COS) der Universität Heidelberg nun aufgezeigt, wie das möglich ist.
Unabhängig davon, wo sie entsteht, löst jede Verletzung über Kalzium-Ionen und die Produktion reaktiver Sauerstoffspezies unspezifische Signale für eine Verletzungsantwort, die Wundheilung, aus. Sie werden intrazellulär durch drei Mitogen-aktivierte Proteinkinasen – p38, JNKs und ERK – übertragen. Die Aktivierung dieser drei MAPK-Moleküle ist sowohl für die Neubildung des Kopfes als auch des Fußes erforderlich. Angestoßen werden nachfolgend dann Wnt-Signalwege, die bei der Embryonalentwicklung für die Bildung von Organanlagen und der Körperachse von Bedeutung sind. Damit werden die generischen Signale der Wundheilung in positionsspezifische Signale der Musterbildung und Zelldifferenzierung für die Regeneration überführt.
„Unsere Experimente zeigen, dass der Wnt-Signalweg zentraler Teil einer zunächst allgemeinen Verletzungsantwort ist und dann je nach Signalstärke das Gewebe in Richtung Kopf- oder Fußentwicklung steuert“, erläutert Prof. Holstein. So ist es auch möglich, bei einer MAPK-Hemmung die ansonsten ausbleibende Regeneration durch künstlich erzeugte, rekombinante Wnt-Proteine anzustoßen. „Überraschend war darüber hinaus, dass auch an mittleren Körperteilen, denen sowohl der Kopf als auch der Fuß entfernt wurde, auf diesem Weg Köpfe an beiden Enden induziert werden können“, ergänzt Dr. Suat Özbek, der Mitglied in Prof. Holsteins Forschungsgruppe „Molekulare Evolution und Genomik“ am COS ist.
Von einem Bestandteil des Wnt-Signalwegs, dem Wnt/β-Catenin, ist bereits bekannt, dass es die Positionsinformation für die Neubildung von Kopfstrukturen kodiert. Das Forschungsteam von Prof. Holstein und Dr. Özbek hat in Zusammenarbeit mit Mathematikern um Prof. Dr. Anna Marciniak-Czochra ein Modell entwickelt, das zeigt, wie eine grundlegende Positionsinformation im Gewebe die anfangs undifferenzierte Verletzungsantwort über den Wnt-Signalweg in einen differentiellen Musterbildungsprozess umwandelt. „Da MAPKs und Wnts in hohem Maße evolutionär konserviert sind, ist dieser Mechanismus wahrscheinlich tief in unserem Genom verankert, was für die regenerativen Prozesse auch bei Vertebraten und Säugern wichtig ist“, betont Thomas Holstein.


























































