Wirkstofftests mit künstlichen Hirngefäßen
Prüfverfahren simuliert Filterwirkung der „Blut-Hirn-Schranke“
Forschende des DZNE präsentieren im Fachjournal „Biomaterials“ eine neuartige Methode zur Wirkstoffprüfung, die bei der Entwicklung von Medikamenten gegen neurodegenerative Erkrankungen helfen könnte. Mit dieser Analysetechnik lässt sich im Labor untersuchen, ob potenzielle Wirkstoffe eine realistische Chance haben, ins Gehirn zu gelangen. Ein Team um Dr. Philip Denner und Dr. Eugenio Fava nutzt dafür menschliche Stammzellen und Mikrokapillaren, die Gefäße des Gehirns und die sogenannte Blut-Hirn-Schranke nachahmen. Das Verfahren ist speziell für entzündungshemmende Wirkstoffe konzipiert.

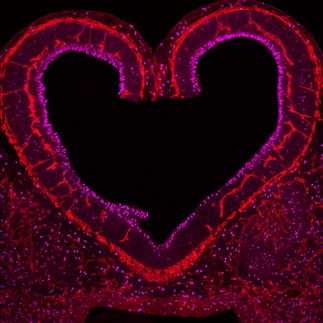
3D-Rekonstruktion eines im Labor hergestellten künstlichen Hirngefäßes mittels Fluoreszenzmikroskopie. Jedes Hirngefäßes besteht aus einzelnen Endothelzellen (in magenta) die über spezielle Zellkontakte, den sogenanten „tight-junctions (türkis) dicht miteinander verbunden sind.
DZNE / LAT
Damit vom Blut keine Schadstoffe oder Krankheitserreger ins Gehirn gelangen, sind die Blutgefäße des Gehirns mit sogenannten Endothelzellen ausgekleidet: Sie bilden die Blut-Hirn-Schranke. „Diese Zellschicht kann man sich wie einen Filter vorstellen, der das Gehirn vor Gefahren schützen soll. Das ist wie bei einem Hochsicherheitsbereich, in den nicht jeder hineindarf“, erläutert Dr. Eugenio Fava, Forscher am DZNE-Standort Bonn und Leiter der „Core Research Facilities & Services“, einer zentralen Einrichtung, die Wissenschaftlerinnen und Wissenschaftlern modernste Messtechnologien zur Verfügung stellt. „Medikamente gegen Hirnerkrankungen müssen deshalb so maßgeschneidert werden, dass sie die Blut-Hirn-Schranke überwinden und so im Gehirn wirken können.“
Notwendige Labortests
Test der Durchlässigkeit – Fachleute sprechen von Permeabilität – spielen deshalb bei der Entwicklung von Medikamenten gegen Hirnerkrankungen eine zentrale Rolle. Ziel solcher Analysen ist es, vielversprechende Substanzen im Labor zu identifizieren, lange bevor klinische Studien am Menschen stattfinden. Solche Untersuchungen werden auch Screening genannt. Bei dieser Frühphase der Wirkstoffentwicklung setzt das Verfahren der Bonner Forschenden an. „Wir sind der Ansicht, dass unser Ansatz die Blut-Hirn-Schranke besser nachahmt als viele derzeit verwendeten Verfahren. Das ermöglicht realistische Vorhersagen zur Aufnahmefähigkeit von Wirkstoffen durch das Gehirn“, so Fava. „Unsere Methode ist speziell auf entzündungshemmende Wirkstoffe zugeschnitten. In den letzten Jahren hat sich nämlich herausgestellt, dass Entzündungsprozesse bei neurodegenerativen Erkrankungen wie etwa Alzheimer eine maßgebliche Rolle spielen.“
Einsatzpotenzial für die neue Screeningmethode gäbe es sowohl in der Wissenschaft als auch in der Pharmaindustrie, meint der DZNE-Forscher: „Die Anwendung geht über Permeabilitätstests von Wirkstoffen hinaus. Manche Hirnerkrankungen beeinträchtigen die Blut-Hirn-Schranke. Mit unserem Modellsystem kann man solche Krankheitsvorgänge an der Grenze zwischen Blutkreislauf und Gehirn nachbilden und untersuchen.“
Zwei Stufen
Das Verfahren umfasst im Wesentlichen zwei Stufen. Zunächst wird der zu prüfende Wirkstoff in wässriger Lösung durch eine technische Vorrichtung geleitet, die die Filterfunktion der Blut-Hirn-Schranke nachahmt. Anschließend wird eine Probe hinter dem Filter entnommen und geprüft, ob der Wirkstoff die Barriere durchdrungen hat. Die entnommene Flüssigkeit wird dazu auf eine Zellkultur menschlicher weißer Blutkörperchen gegeben. „Diese Immunzellen dienen als Sensoren“, erläutert der Molekularbiologe Dr. Sven Fengler, der an der Entwicklung des neuen Screeningverfahrens maßgeblich beteiligt war. „Wenn die Flüssigkeit, die von unserer Filterapparatur stammt, entzündungshemmende Stoffe enthält, wird die klassische Immunantwort der weißen Blutkörpern gehemmt. Ist der Wirkstoff nicht vorhanden, kommt es zu einer normalen Immunreaktion.“
Da an dieser Stelle eine auf Immunreaktionen beruhende Nachweismethode zum Einsatz kommt, ist das Screeningverfahren auf entzündungshemmende Wirkstoffe ausgerichtet. Herzstück des Ansatzes der Bonner Forschenden ist gleichwohl die „Filtervorrichtung“, die sich prinzipiell auch für Permeabilitätstest anderer Wirkstofftypen eignet. „In dieser Komponente steckt die eigentliche Entwicklungsarbeit“, so Fengler.
Filigrane Kanäle
Ein wesentlicher Bestandteil der Hardware sind spezielle, etwa handgroße Kunststoffplatten, die für Experimente mit winzigen Flüssigkeitsmengen („Mikrofluidik“) kommerziell verfügbar sind. Diese Platten werden von einem Netzwerk haarfeiner Röhrchen durchzogen. In einige Bereiche dieses Kanalsystems bringen die Wissenschaftlerinnen und Wissenschaftler des DZNE Endothelzellen ein, die die Innenwände der Kapillaren mit einer dichten Zellschicht bedecken. Auf diese Weise entstehen Gefäße, die menschlichen Hirngefäßen nachempfunden sind. Die dafür verwendeten Endothelzellen werden vorab aus reprogrammierten menschlichen Stammzellen gezüchtet: zellulären „Alleskönnern“, die sich – passend beeinflusst – in verschiedenste Zelltypen umwandeln können.
In das Verfahren zur Herstellung der künstlichen Hirngefäße sind rund 4 Jahre an Forschung eingeflossen. In Kombination mit den vorgefertigten Mikrofluidik-Platten ermöglicht das Protokoll solche Gefäße in standardisierter und reproduzierbarer Qualität herzustellen. „Unsere künstlichen Gefäße bilden ein Modell der menschlichen Blut-Hirn-Schranke, das der realen Situation recht nahekommt. Das zeigen Messungen des elektrischen Widerstands der Endothelschicht, an der sich die Dichtigkeit dieser Barriere ablesen lässt, und diverse andere Charakterisierungen. Wichtig ist auch, dass unser Versuchsaufbau die Flüssigkeit innerhalb der Gefäße in Bewegung hält, um den Blutfluss zu simulieren“, sagt Fengler.
Mehrere Messungen gleichzeitig
Pro Platte können die Wissenschaftlerinnen und Wissenschaftler 40 solcher Gefäße herstellen, einzeln ansteuern und somit 40 Wirkstoffe gleichzeitig testen. Ein Testlauf dauert rund zwei Wochen inklusive Vorbereitungen, denn für jeden Prüfvorgang müssen die künstlichen Hirngefäße in einer zunächst „nackten“ Platte neu heranwachsen. Für die Messung der Permeabilität ist nun entscheidend, dass jeder der Kanäle, in denen die Gefäße entstehen, punktuell mit einem weiteren Kanal verbunden ist, der keine Endothelzellen enthält. In die Engstelle zwischen den Kanälen wird ein spezielles Gel eingebracht. Im Kontaktbereich liegen die Endothelzellen, die in nur einem der Kanäle vorhandenen sind, somit direkt auf dem Gel. „Dieses Gel dichtet die Kapillaren einerseits ab und ermöglicht andererseits chemischen Substanzen, die durch die Schicht der Endothelzellen dringen, dann weiter in den anderen Kanal zu diffundieren. Dies entspricht der Situation, dass diese Wirkstoffe ins Gehirn gelangen“, so Fengler.
Perspektiven
Die Wissenschaftlerinnen und Wissenschaftler des DZNE haben das neue Verfahren inzwischen an verschiedenen Testsubstanzen erfolgreich erprobt. „Unsere Methode ist recht aufwändig und daher eher auf Präzision getrimmt. Die Besonderheit des Versuchsaufbaus besteht jedoch darin, dass die Methode zur Untersuchung mehrerer hundert Proben in einem sogenanten High-Content-Screening Verfahren angewendet werden kann. Einsatzmöglichkeiten sehen wir dort, wo es darum geht, aus einer kleineren Anzahl schon vorsortierter Wirkstoffkandidaten jenen herauszufinden, der die besten Chancen hat, das Gehirn in ausreichender Menge zu erreichen“, so Philip Denner. „Wir wollen unseren Ansatz nun weiter optimieren und langfristig daraus vielleicht ein marktfähiges Verfahren entwickeln.“