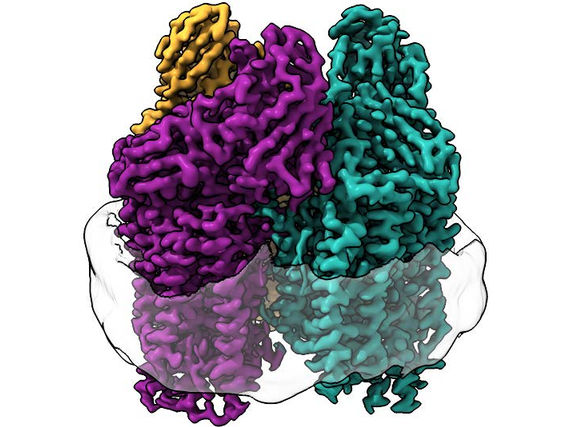
Die komplexesten Knoten in Proteinen
Theoretische Physiker stellen Googles künstliche Intelligenz AlphaFold auf die Probe und finden die bisher komplexesten Proteinknoten
Die Frage danach, wie die chemische Zusammensetzung eines Proteins dessen 3-D-Struktur bestimmt, ist schon seit über einem halben Jahrhundert eine der größten Herausforderungen der Biophysik. Dieses Wissen um die sogenannte „Faltung“ von Proteinen ist zu Recht heiß begehrt, denn es trägt unter anderem maßgeblich zum Verständnis diverser Krankheiten und deren Behandlung bei. Aus diesen Gründen hat Googles Forschungsteam DeepMind die künstliche Intelligenz AlphaFold entwickelt, welche 3-D-Strukturen vorhersagt.
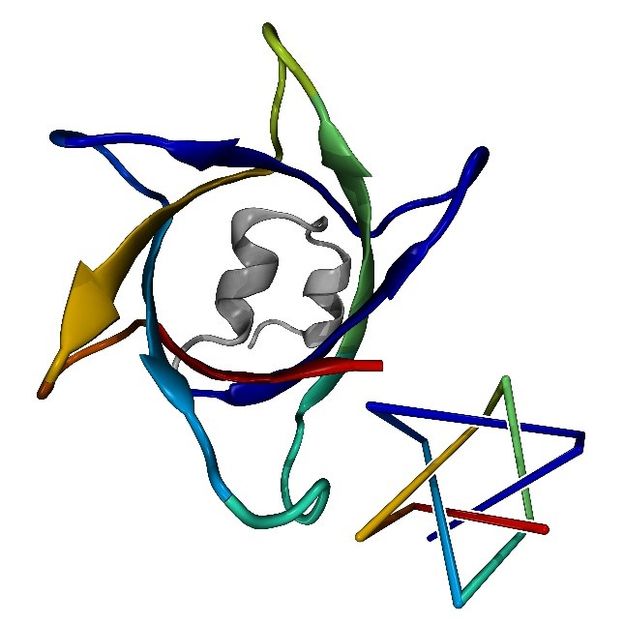
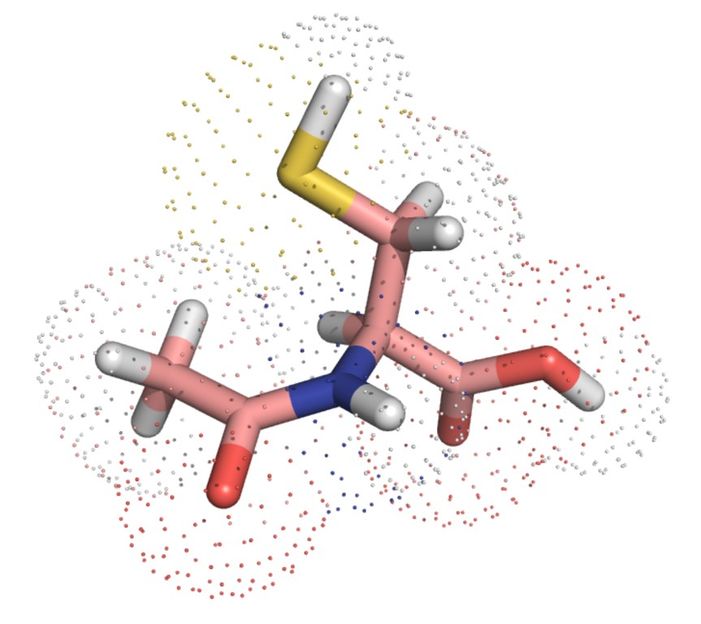
Der komplexeste Proteinknoten mit sieben Überkreuzungen (l.), vorhergesagt durch AlphaFold, und eine vereinfachte Darstellung (r.)
© Maarten Brems
Ein Team bestehend aus Forschern der Johannes Gutenberg-Universität Mainz (JGU) und der University of California, Los Angeles, hat sich diese Strukturen nun etwas genauer angeschaut und auf Verknotungen untersucht. Knoten kennen wir vor allem von Schnürsenkeln und Kabeln – doch treten sie auch mikroskopisch klein in unseren Zellen auf. Verknotete Proteine können nicht nur zur Einschätzung der Güte der Vorhersagen herangezogen werden, sondern werfen darüber hinaus wichtige Fragen zu Faltungsmechanismen und der Evolution von Proteinen auf.
Die komplexesten Knoten als Test für AlphaFold
„Wir haben alle, nämlich einige 100.000 Vorhersagen von AlphaFold numerisch nach neuen Proteinknoten durchsucht“, sagt Maarten A. Brems, Doktorand in der Gruppe von Dr. Peter Virnau an der JGU. Ziel war es, seltene, qualitativ hochwertige Strukturen zu identifizieren, welche komplexe und bisher unbekannte Proteinknoten enthalten, um eine Basis für die experimentelle Verifizierung von AlphaFolds Vorhersagen zu schaffen. Bei der Untersuchung wurde nicht nur das bisher am komplexesten verknotete Protein gefunden, sondern auch die ersten Kompositknoten in Proteinen. Letztere kann man sich vorstellen wie zwei getrennte Knoten in der gleichen Schnur. „Diese neuen Entdeckungen geben außerdem Einsicht in die evolutionären Mechanismen hinter solchen seltenen Proteinen“, ergänzt der theoretische Physiker Robert Runkel, der ebenfalls am Projekt beteiligt war. Die Resultate wurden jetzt im Journal Protein Science veröffentlicht.
Über die Ergebnisse freut sich auch Peter Virnau: „Wir haben bereits eine Kollaboration mit unserem Kollegen Todd Yeates von der UCLA etabliert, um diese Strukturen experimentell zu bestätigen. Diese Forschungsrichtung wird den Blick der Biophysik-Community auf die künstliche Intelligenz prägen und wir sind glücklich, einen Experten wie Dr. Yeates dabei zu haben.“
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
John Jumper et al.; Highly accurate protein structure prediction with AlphaFold; Nature, 15. Juli 2021
Maarten Brems, Robert Runkel, Todd Yeates, Peter Virnau; AlphaFold predicts the most complex protein knot and composite protein knots; Protein Science, 13. Juli 2022
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Deutschlandweit größte Sammlung von ölabbauenden Mikroorganismen in Greifswald

Schlüssel für einen preiswerten und besser zugänglichen Hib-Impfstoff gefunden - Möglicher Ansatz für neue Impfstoffe und Medikamente gegen Bakterien

Consejo Superior De Investigaciones Científias (CSIC) - Madrid, Spanien
"Blitzableiter" schützt Zellen vor oxidativen Schäden

Patentanmeldungen europäischer Hochschulen nehmen zu - Die Landschaft wird von einer Handvoll besonders aktiver Hochschulen beherrscht

Palletank® for Mixing | Palettentanks | Sartorius