Grüne Welle für „Gen-Taxis“
Erkenntnissprung bei Peptid-Nanofibrillen
Viren helfen Forschenden dabei, Gene in Zellen zu schleusen – damit diese beispielsweise pharmazeutische Wirkstoffe herstellen. Spezielle Peptide kurbeln den Vorgang an. Verstanden allerdings war die Effizienzsteigerung bislang kaum. Ein Forscherteam des MPI für Polymerforschung, der Universität Ulm, der britischen Universität Cambridge und der niederländischen Wageningen University konnte nun Licht ins Dunkel bringen und zudem ein kostengünstiges Peptid entwickeln. Seine Ergebnisse veröffentlichte das Team im Magazin „Advanced Functional Materials“.

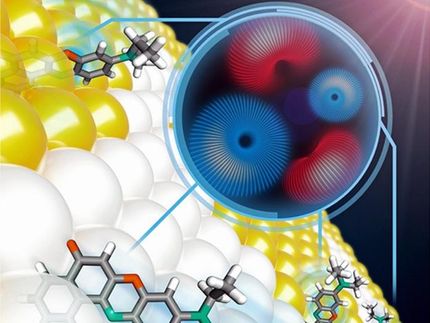
Mit speziellen Peptiden kann die Effizienz, mit der Viren genetisches Material in Zellen einschleusen, erhöht werden.
Max-Planck-Institut für Polymerforschung
Biochemiker brauchen „Taxis“ der besonderen Art: Diese sollen, bepackt mit genetischer Information, in die Zellen eindringen und sie dazu anregen, ihre eigentliche Aufgabe ad acta zu legen und stattdessen gewünschte Wirkstoffe zu produzieren, beispielsweise Insulin. Auch für neuartige Therapieansätze sind solche molekularen Lieferdienste interessant. So etwa bei der Car-T-Zelltherapie, für die es bereits erste Ansätze gibt. Dabei entnimmt man Krebspatientinnen und Krebspatienten einige T-Zellen, programmiert sie in der Petrischale um und gibt sie wieder zurück in den Körper – wo sie dann gezielt die Tumorzellen abtöten. Auch hier ist ein effizienter Gentransporter in die T-Zellen hinein gefragt, um diese möglichst umfassend umprogrammieren zu können. Viren bieten sich als solche „Taxis“ an – schließlich sind sie Meister darin, die Zellmembran zu überwinden. Faserbildende Peptide, also kurze Sequenzen von Aminosäuren, die über elektrostatische Bindungen an Viren andocken, steigern diese Fähigkeit nochmals. Bei den Fragen, warum dies so ist und welche Peptide die Effizienz des Transports am besten erhöhen, hat die Forschung bisher noch keine zufriedenstellende Antwort gefunden.
Peptiddatenbank ermöglicht fundamentales Verständnis
Forschende des MPI für Polymerforschung konnten dieses Rätsel nun gemeinsam mit Kolleginnen und Kollegen der Universitäten Ulm, Cambridge sowie der Wageningen University lösen. „Wir konnten erstmalig physikalisch-chemische Parameter der Peptide mit der Infektiosität korrelieren, also mit der Fähigkeit der Viren, die Zellwand zu überwinden“, erläutert Christopher Synatschke, Gruppenleiter im Arbeitskreis von Tanja Weil am MPI für Polymerforschung. Die Grundlage für diese Erkenntnisse schufen die Forscherinnen und Forscher mit einer Peptiddatenbank. „Gibt man die Peptide in eine wässrige Lösung, so bilden sich aus Millionen oder Milliarden von Einzelmolekülen lange Fasern aus – die sogenannten supramolekularen Peptid-Nanofibrillen. Wir haben versucht, diese Strukturbildung zu beeinflussen, indem wir systematisch Aminosäuren ausgetauscht, Peptide gekürzt und physikalisch-chemische Parameter wie die Hydrophilie – also die „Wasserliebe“ – geändert haben“, erläutert Synatschke. Unter welchen Bedingungen entstehen Nanofasern, die das Eindringen der Viren in die Zellen besonders effizient unterstützen, wann bilden sich dagegen keine Nanofasern aus? Welche Molekülteile sind essentiell? Lässt sich die Faserbildung über bestimmte physikalisch-chemische Parameter verbessern? All diese Daten trug das Team in der Datenbank zusammen – und erarbeitete sich somit Schritt für Schritt das Wissen darüber, wie sich deutlich effizientere Peptid-Strukturen erzeugen lassen.
Die wichtigen Parameter: Zunächst einmal müssen die Peptide überhaupt Fasern ausbilden. Weiter braucht es eine positive Oberflächenladung der Fasern, damit sie von Viren und Zelloberflächen angezogen werden und das Virus somit effizient an die Zelloberfläche bringen können. Und, das interessanteste: Die Sekundärstruktur der Fasern, wie sie beispielsweise von der Doppelhelixstruktur des Erbguts bekannt ist, eine etwas Unbekanntere ist die ß-Faltblattstruktur. Sie gibt quasi an, wie die Fasern in sich verknäult sind. Die vereinfachte Faustformel lautet: Je mehr Faserabschnitte sich in einer ß-Faltblattstruktur anordnen, je effizienter helfen die Fasern den Viren dabei, die Zellmembranen zu überwinden.
Das gewonnene Wissen setzte das Forscherteam direkt um. „Wir konnten ein Peptid herstellen, das ebenso effizient ist wie ein bereits bekanntes, jedoch statt aus zwölf Aminiosäuren nur aus sieben besteht und sich daher deutlich kostengünstiger herstellen lässt“, erklärt Synatschke. Die Ergebnisse veröffentlichten die Forscherinnen und Forscher im Magazin „Advanced Functional Materials“.
Auch gegenteilige Peptid-Eigenschaften sind interessant
Interessant ist die Datenbank auch für zahlreiche weitere Fragestellungen. So könnte man die Erkenntnisse nutzen um Peptide herzustellen, die zwar an Viren, nicht jedoch an Zellen binden – sie würden die Fähigkeiten der Viren, in die Zellen einzudringen, also reduzieren statt sie zu vergrößern. Auf diese Weise könnten die Peptide die Infektiosität senken, was neue Ansätze bei virusbedingten Krankheiten wie HIV ermöglichen kann. Bis dahin ist haben die Forschenden jedoch noch einen langen Weg vor sich.
Originalveröffentlichung
Sieste, S.; Mack, T.; Lump, E.; Hayn, M.; Schütz, D.; Röcker, A.; Meier, C.; Kirchhoff, F.; Knowles, T. P.J.; Ruggeri, F. S. et al.: Supramolecular Peptide Nanofibrils with Optimized Sequences and Molecular Structures for Efficient Retroviral Transduction. Advanced Functional Materials 31 (17), 2009382 (2021)