Zellen mit dem Laser steuern
Wenn man im Labor Gewebe erzeugt, soll nichts dem Zufall überlassen bleiben
An der TU Wien wurde eine Methode entwickelt, um einzelne Zellen mit Laserpräzision an die richtige Stelle zu leiten.
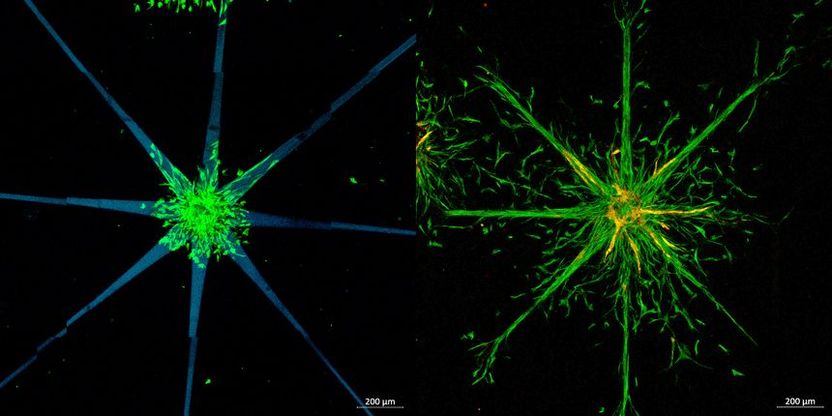
Sternförmige Muster wurden angefertigt (links), in die Zellen dann nach und nach hineinwandern (rechts).
Technische Universität Wien
Es ist eines der größten Probleme beim Herstellen von künstlichem Gewebe: Wie schafft man es, die einzelnen Zellen an den richtigen Ort zu dirigieren, etwa wenn ein Blutgefäß an einer ganz bestimmten Stelle entstehen soll? An der TU Wien ist dieses Kunststück nun gelungen: Das Hydrogel, in dem sich die Zellen befinden, wird mit ganz speziellen Molekülen angereichert, die dann mit einem Laserstrahl aktiviert werden können. Genau an diesen Stellen wird das Hydrogel dann weicher und durchlässiger, so kann man genau bestimmen, wohin sich die Zellen bewegen sollen.
Die neue Technik ist besonders für die tierversuchsfreie Pharma-Forschung interessant: Mit dieser Laser-Methode kann man auf reproduzierbare Weise spezielle Gewebesysteme herstellen, die man dann unter genau kontrollierten Bedingungen am Chip untersucht, etwa um neue Medikamente zu testen.
Wie ein Gummibärchen im Wasser
„Beim Herstellen von Gewebe beginnt man oft mit lebenden Zellen, die in ein Hydrogel eingebettet sind“, sagt Prof. Aleksandr Ovsianikov, Leiter der Forschungsgruppe 3D Printing and Biofabrication an der TU Wien. Das Hydrogel ist ein biokompatibles Material, mit Eigenschaften, die denen von Gewebe sehr ähnlich sind. „Vergleichbar mit einem aufgequollenen Gummibärchen, das sich mit Wasser vollgesogen hat“, erklärt Ovsianikov. Die Zellen können durch das Hydrogel hindurchwandern und ein Gewebe bilden. Es wäre jedoch wünschenswert, diesen Prozess kontrollieren zu können und zu erreichen, dass sich die Zellen dabei an einen vorgegebenen Bauplan halten.
In der Forschungsgruppe für 3D-Printing und Biofabrication hat man dem Hydrogel nun allerdings ganz spezielle Moleküle hinzugefügt. Normalerweise verändern sie das Verhalten des Hydrogels nicht, aber wenn sie mit einem Laser aktiviert werden, dann wird genau an dieser Stelle das Hydrogel weicher und durchlässiger. „Das Molekül koppelt sich ans Netzwerk des Hydrogels, an dieser Stelle wird das Netzwerk hydrophiler. Dadurch ändern sich die physikalischen Eigenschaften, und auf diese Weise ist es möglich, ein 3D-Muster zu erzeugen, durch das die Zellen leichter durchwandern können als anderswo“, erklärt Simon Sayer (TU Wien).
Im Experiment gab man auf diese Weise mit dem Laserstrahl bestimmte Wege im Hydrogel vor – und tatsächlich bewegten sich die Zellen dann genau auf diesen Pfaden. So konnte man stern- oder gitterförmige Zellstrukturen herstellen.
Human on a Chip
Im Fokus dieser Forschung steht vorerst nicht unbedingt die Erzeugung künstlicher Organe, sondern eine Technologie, die oft „Organ on a Chip“ oder auch „Human on a Chip“ genannt wird: Man erzeugt Gewebeteile, die dann auf einem wenige Zentimeter großen Chip miteinander interagieren, auf hochpräzise Weise mit ganz bestimmten Nährstoffen oder auch mit pharmazeutischen Präparaten versorgt werden können. Auf diese Weise kann man wichtige Information über die Wirkung von Medikamenten sammeln, ohne auf Tierversuche zurückgreifen zu müssen. Außerdem kann man mit menschlichen Zellen arbeiten, die Resultate werden dadurch viel aussagekräftiger.
„Das funktioniert aber nur dann, wenn wir die Eigenschaften dieser Gewebe exakt steuern können“, sagt Tommaso Zandrini (TU Wien). „Erstens müssen diese Experimente reproduzierbar sein, daher möchte man mehrere Gewebeproben mit genau derselben Mikrostruktur, und zweitens müssen die unterschiedlichen Proben auch genau aufeinander abgestimmt werden können – etwa wenn man die Wechselwirkung zwischen einem kleinen Stück Herzmuskelgewebe und einem kleinen Stück Lebergewebe untersucht.“ Um den Zusammenhang genau zu verstehen, müssen sich Strukturen wie etwa Blutgefäße genau an der richtigen Stelle befinden. Das wird nun mit der Laser-Steuerungsmethode möglich. Die erreichbare Komplexität maßgeschneiderter Gewebeproben kann damit drastisch erhöht werden.