“Wachsendes Ende” von Entzündungen entdeckt
Erkenntnis hat das Potenzial chronischen Entzündungskrankheiten Einhalt zu gebieten
Rötung, Schwellung, Schmerz – das sind Anzeichen einer Entzündung. Sie dient dem Schutz des Körpers vor Krankheitserregern oder Fremdstoffen. Forschende der Universitäten Bonn und Köln konnten zeigen, dass Entzündungsreaktionen eines wichtigen Sensorproteins in einer bestimmten räumlichen Richtung ablaufen. Diese Erkenntnis hat das Potenzial, Entzündungen möglicherweise am „wachsenden Ende“ zu stoppen, und somit chronischen Entzündungskrankheiten Einhalt zu gebieten.
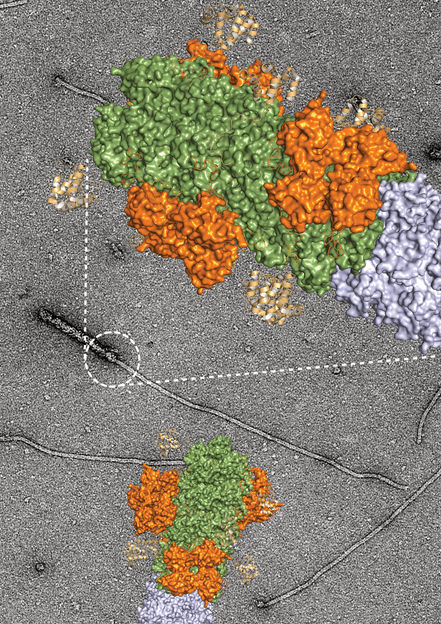
Elektronenmikroskopische Aufnahme des Übergangs zwischen dem Gefahrensensor NLRP3 und seinem Signalprotein, dargestellt in der Vergrößerung mit der berechneten Proteinstruktur.
Inga V. Hochheiser
Wenn Bakterien oder Viren lebende Zellen befallen oder darin sonstige Fremdstoffe auftreten, wird der Gefahrensensor mit dem Kürzel NLRP3 aktiviert. “Auch die für die Alzheimer-Erkrankung charakteristischen Eiweißablagerungen im Gehirn, die so genannten Amyloid-ß-Plaques, können NLRP3 in Gang setzen”, verweist Prof. Dr. Matthias Geyer vom Institut für Strukturbiologie des Universitätsklinikums Bonn auf frühere Studien. Wie diese vorangehenden Untersuchungen der Forscher zeigen, befeuert diese Reaktion sich zunehmend selbst: Die durch NLRP3 ausgelöste Entzündungsrektion fördert die weitere Ablagerung von Amyloid-ß-Plaques und trägt maßgeblich zum Krankheitsgeschehen bei.
Einmal aktiviert, lagern sich mehrere NLRP3-Proteine aneinander an und bilden so den Keim für eine fadenförmige Struktur, an der sich immer weitere Proteine sammeln. “Die Reaktion kommt in Gang, sobald etwa ein Dutzend der NLRP3-Moleküle vorliegt”, berichtet Geyer. Theoretisch können sich unendlich viele NLRP3-Moleküle aneinander lagern und die fadenförmige Struktur – wissenschaftlich “Filament” genannt – immer weiter verlängern. Inga Hochheiser aus Prof. Geyers Team konnte nun zeigen, in welche Richtung dieses Filament wächst und sich weiter ausdehnt. “Diese Einblicke konnten wir mit Hilfe der Cryo-Elektronenmikroskopie gewinnen. Diese Methode erlaubt es, Eiweiß-Moleküle mit bis zu 80.000-facher Vergrößerung zu beobachten und so direkt sichtbar zu machen”, sagt Hochheiser.
“Standbild” von der fadenförmigen Struktur unter dem Mikroskop
In winzigen Schritten träufelte die Wissenschaftlerin aus Zellen isoliertes NLRP3 auf einen Probenträger und fror diese Mischung schlagartig ein. Dadurch bekamen die Forscher unter dem Cryo-Elektronenmikroskop eine Art “Standbild” von der entstehenden fadenförmigen Struktur aneinandergelagerter NLRP3-Moleküle. “Aus diesen Einzelbildern ließ sich wie in einem Film nachvollziehen, wie sich die Filamente verlängern”, sagt Hochheiser. Da beim Träufeln die Moleküle unterschiedlich auf den Probenträger fallen, sind sie unter dem Mikroskop aus verschiedenen Perspektiven zu sehen. Diese unterschiedlichen Ansichten lassen sich am Computer zu einem dreidimensionalen Bild kombinieren. Dabei zeigte sich, dass sich die Filamente nur in eine Richtung ausbilden. „So konnten wir einen Teil des Entzündungsapparates sichtbar machen und die Wachstumsrichtung buchstäblich ablesen“, sagt Prof. Geyer, der die Studie geleitet hat und Mitglied im Exzellenzcluster ImmunoSensation2 und dem Transdisziplinären Forschungsbereich „Life and Health“ der Universität Bonn ist.
Chronische Entzündungskrankheiten stoppen
“Die technische Herausforderung bestand darin, die Übergänge in den fadenförmigen Strukturen zu finden und im Bild sichtbar zu machen”, sagt Prof. Dr. Elmar Behrmann vom Institut für Biochemie der Universität zu Köln. “Die neuen Erkenntnisse erlauben nun, das wachsende Ende der Entzündungsreaktion mit Hilfe von Antikörpern oder Wirkstoffen gezielt zu adressieren”, sagt Hochheiser. Damit kommen die Forschenden dem Ziel näher, den weiteren Aufbau des Entzündungsapparates zu stoppen und auf diese Weise chronischen Entzündungen entgegenzuwirken.