Tumoren auf Entzug: Aminosäuremangel lässt kindliche Tumoren schrumpfen
Krebszellen leiteten ihre eigene Selbstzerstörung durch Ferroptose ein
Bestimmte kindliche Tumoren sind wahre Aminosäure-Monster. Wissenschaftlerinnen und Wissenschaftler des Hopp-Kindertumorzentrum Heidelberg (KiTZ), des Deutschen Krebsforschungszentrums (DKFZ), der Universität Heidelberg und der HI-STEM gGmbH haben jetzt entdeckt, welche molekularen Mechanismen dem zugrunde liegen und wie man den Krebszellen den Hahn abdrehen könnte.
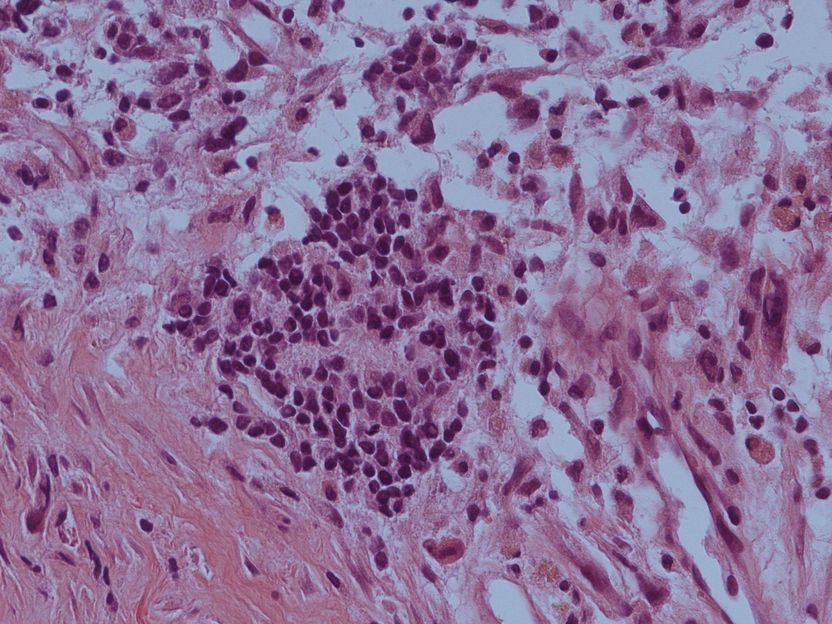
Der histologische Schnitt zeigt eine Ansammlung von aggressiven Neuroblastoma Zellen in der Mitte des Bildes.
© Westermann/DKFZ
Pro Jahr erkrankt etwa eines von 100.000 Kindern neu an einem Neuroblastom, oft schon im ersten Lebensjahr. Damit sind Neuroblastome eine bei Kindern relativ häufige Gruppe von Tumoren. Sie bilden sich bereits in der Embryonalentwicklung im unreifen Nervengewebe aus und kommen vor allem in der Nebenniere, der Wirbelsäule, im Halsbereich sowie im Brust-, Bauch- und Beckenraum vor. Neuroblastome sind schwer zu behandeln und häufig therapieresistent. Betroffen sind insbesondere Säuglinge und Kleinkinder. In einigen Fällen bildet sich der Tumor ohne jegliche Therapie komplett zurück. Bei etwa der Hälfte der Patienten schreitet er jedoch trotz hochintensiver Therapie unaufhaltsam voran.
Eine wichtige Stellschraube, die darüber entscheidet, in welche Richtung sich die Erkrankung entwickelt, ist das Krebsgen MYCN. Erst kürzlich wurde bekannt, dass dieses Krebsgen die Weichen stellt, ob sich Vorläuferzellen in reife Nervenzellen entwickeln oder zu bösartigen Neuroblastomzellen werden. Neuroblastome mit ungünstigem Verlauf tragen zudem hunderte aktive Kopien des MYCN-Gens in ihrem Erbgut. Die hohe MYCN-Aktivität führt dazu, dass der Metabolismus der Krebszellen tiefgreifend verändert wird, weil MYCN wiederum eine Vielzahl anderer Gene an- und abschaltet. Aber welchen Vorteil bringt das der Krebszelle und lässt sich dieses hochspezielle Netzwerk gezielt stören, um die Krebszellen aktiv zu bekämpfen?
Diese Fragen stellte sich das Wissenschaftlerteam, geleitet von Frank Westermann vom Hopp-Kindertumorzentrum Heidelberg (KiTZ) und vom Deutschen Krebsforschungszentrum (DKFZ), Andreas Trumpp, DKFZ und HI-STEM gGmbH und Thomas Höfer vom DKFZ. In der vorliegenden Studie haben die Erstautoren Hamed Alborzinia und Andres Florez entdeckt, dass Neuroblastomzellen mit hoher MYCN-Aktivität vor allem eines brauchen: die Aminosäure Cystein. Cystein ist ein wichtiger Baustein für die meisten zellulären Eiweiße und Fette. Die schnellwachsenden Krebszellen benötigen große Mengen dieser Bausteine, um neue Zellen zu produzieren.
Gleichzeitig brauchen die Krebszellen Cystein, um sich vor natürlich entstehenden giftigen Peroxiden zu schützen, die bedingt durch ihren hochaktiven Stoffwechsel entstehen. „Der Cystein-Hunger von Neuroblastomzellen ist dabei so groß, dass sie gleich zwei Wege nutzen, um sich das Cystein zu beschaffen“, sagt Sina Kreth, ebenfalls Erstautorin der Studie. „Sie nutzen den Import der Aminosäure und kurbeln zusätzlich einen alternativen Syntheseweg an, um Cystein aus der Aminosäure Methionin zu gewinnen“, ergänzt Erstautorin Lena Brückner.
Genau diese Anpassungsprozesse machen die Neuroblastomzellen aber auch empfindlich. Entzogen die Wissenschaftler ihnen das Cystein, konnten die durch MYCN angetriebenen Tumorzellen die entstehenden giftigen Peroxide nicht mehr inaktivieren und starben durch eine besondere Form des Zelltods, der Ferroptose. Ob dieser Prozess eine mögliche Achillesferse für eine Therapie gegen bösartige Neuroblastome sein könnte, testete das Forscherteam daraufhin in Mäusen.
Die Wissenschaftler drehten den Tumoren ganz gezielt den Hahn ab: Sie blockierten die Cysteinaufnahme, die Cysteinsynthese und schalteten zudem ein Schlüsselenzym aus, das normalerweise verhindert, dass sich die Krebszelle durch Peroxide vergiftet. Die Krebszellen leiteten daraufhin ihre eigene Selbstzerstörung durch Ferroptose ein und die Tumoren schrumpften.
„Der Ferroptose-Zelltod wurde erst vor wenigen Jahren entdeckt und die Ergebnisse zeigen nun erstmals nicht nur in Zellkulturen, sondern auch in krebstragenden Mäusen, wie sich dieser Prozess manipulieren lässt, um hochaggressive humane Neuroblastomzellen durch Induktion der Ferroptose abzutöten“, betont Hamed Alborzinia.
Die Ergebnisse liefern auch eine mögliche Erklärung, warum einige Neuroblastome mit moderater MYCN-Aktivität bei Säuglingen und Kleinkindern in einigen Fällen einfach verschwinden: „Zellen nehmen in den ersten Lebensjahren grundsätzlich weniger Cystein auf. Wenn sie beginnen, sich unkontrolliert zu teilen, gehen ihnen daher bald die Cystein-Reserven aus und der ferroptotische Zelltod wird eingeleitet“, erklärt Andres Florez. Einige Neuroblastome ohne MYCN-Aktivität können dieser Selbstzerstörung nicht entgehen und sterben dann nach einer gewissen Zeit einfach ab, wenn das Cystein knapp wird.
Für Hochrisikopatienten mit hoher MYCN-Aktivität liefert die Studie erste Erkenntnisse, wie sich das Gleichgewicht zwischen Cysteinaufnahme, -produktion und -verbrauch möglicherweise so stören ließe, dass auch diese Zellen ihre Selbstzerstörung einleiten. Ob sich das neu entdeckte Prinzip auch in der Therapie von Neuroblastom-Patienten bewährt, muss nun in klinischen Studien getestet werden.