Eine neue Ära der mitochondrialen Genom-Editierung hat begonnen
Wissenschaftlern gelingt Umwandlung von A- in G-Basen, das letzte fehlende Puzzlestück in der Gen-Editing-Technologie
Forscher des Zentrums für Genomtechnik im Institut für Grundlagenforschung haben eine neue Gen-Editierungsplattform entwickelt, die "transcription activator-like effector-linked deaminases" (TALED). TALEDs sind Basen-Editoren, die in der Lage sind, in Mitochondrien eine Basenumwandlung von A nach G vorzunehmen. Diese Entdeckung war der Höhepunkt einer jahrzehntelangen Reise zur Heilung menschlicher Erbkrankheiten, und TALED kann als das letzte fehlende Puzzlestück in der Gene-Editing-Technologie angesehen werden.
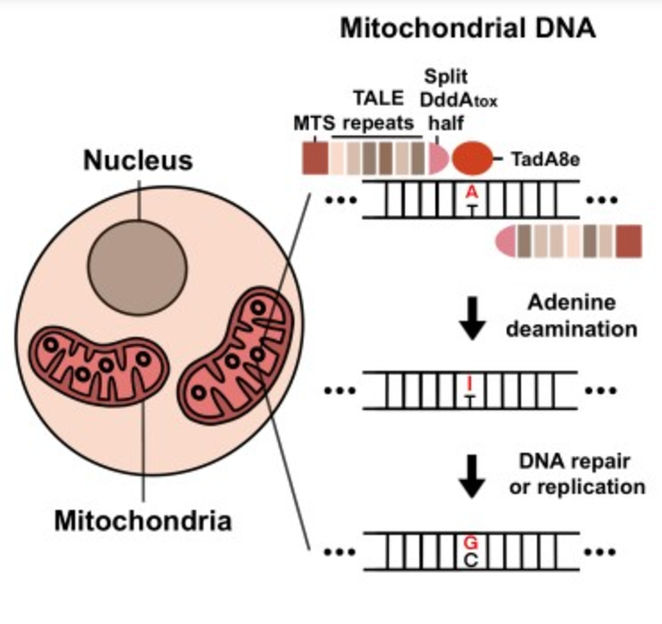
Grafische Zusammenfassung, die zeigt, wie TALEDs in Mitochondrien funktionieren. Zunächst wird Adenin zu Inosin desaminiert. Anschließend wird Inosin durch DNA-Reparatur oder -Replikation in Guanin umgewandelt.
Institute for Basic Science
Seit der Entdeckung des ersten Restriktionsenzyms im Jahr 1968, der Erfindung der Polymerase-Kettenreaktion (PCR) im Jahr 1985 und der Demonstration der CRISPR-vermittelten Genom-Editierung im Jahr 2013 hat jede neue bahnbrechende Entdeckung in der Biotechnologie unsere Möglichkeiten zur Manipulation der DNA, des Bauplans des Lebens, weiter verbessert. Insbesondere die jüngste Entwicklung des CRISPR-Cas-Systems, der "genetischen Schere", hat ein umfassendes Genome Editing lebender Zellen ermöglicht. Dies eröffnete neue Möglichkeiten für die Behandlung bisher unheilbarer genetischer Krankheiten, indem die Mutationen aus unserem Genom herausgeschnitten werden.
Während das Gen-Editing im Kerngenom der Zellen weitgehend erfolgreich war, sind die Wissenschaftler beim Editing der Mitochondrien, die ebenfalls ein eigenes Genom besitzen, nicht erfolgreich gewesen. Mitochondrien, das so genannte "Kraftwerk der Zellen", sind winzige Organellen in den Zellen, die als Energieerzeugungsfabriken dienen. Da es sich um eine wichtige Organelle für den Energiestoffwechsel handelt, führt eine Mutation des Gens zu schweren genetischen Krankheiten im Zusammenhang mit dem Energiestoffwechsel.
Direktor KIM Jin-Soo vom Center for Genome Engineering erklärte: "Es gibt einige äußerst unangenehme Erbkrankheiten, die auf Defekte in der mitochondrialen DNA zurückzuführen sind. So wird beispielsweise die Leber hereditäre Optikusneuropathie (LHON), die zur plötzlichen Erblindung auf beiden Augen führt, durch eine einfache Punktmutation in der mitochondrialen DNA verursacht." Eine weitere mitochondriale Generkrankung ist die mitochondriale Enzephalomyopathie mit Laktatazidose und schlaganfallähnlichen Episoden (MELAS), die das Gehirn des Patienten langsam zerstört. Einige Studien deuten sogar darauf hin, dass Anomalien in der mitochondrialen DNA auch für degenerative Krankheiten wie die Alzheimer-Krankheit und Muskeldystrophie verantwortlich sein könnten.
Das mitochondriale Genom wird in der mütterlichen Linie vererbt. Es sind 90 krankheitsverursachende Punktmutationen in der mitochondrialen DNA bekannt, von denen insgesamt mindestens 1 von 5.000 Personen betroffen ist. Viele der vorhandenen Genom-Editierungswerkzeuge konnten aufgrund von Einschränkungen bei der Übertragung auf die Mitochondrien nicht verwendet werden. So ist beispielsweise die CRISPR-Cas-Plattform nicht für die Bearbeitung dieser Mutationen in Mitochondrien geeignet, da die Leit-RNA nicht in die Organelle selbst eindringen kann.
"Ein weiteres Problem ist, dass es an Tiermodellen für diese mitochondrialen Krankheiten mangelt. Das liegt daran, dass es derzeit nicht möglich ist, mitochondriale Mutationen zu erzeugen, die für die Schaffung von Tiermodellen notwendig sind", fügte Direktor Kim hinzu. "Der Mangel an Tiermodellen erschwert die Entwicklung und Prüfung von Therapeutika für diese Krankheiten.
Eine verlässliche Technologie zur Veränderung der mitochondrialen DNA ist daher eine der letzten Grenzen des Genome Engineering, die erforscht werden muss, um alle bekannten genetischen Krankheiten zu besiegen, und die besten Wissenschaftler der Welt bemühen sich seit Jahren darum, sie Wirklichkeit werden zu lassen.
Im Jahr 2020 haben Forscher unter der Leitung von David R. LIU vom Broad Institute in Harvard und vom MIT einen neuen Basen-Editor namens DddA-derived cytosine base editors (DdCBEs) entwickelt, der eine C-zu-T-Umwandlung von DNA in Mitochondrien durchführen kann. Ermöglicht wurde dies durch die Entwicklung einer neuen Gentechnologie, dem so genannten Base Editing, bei dem eine einzelne Nukleotidbase in eine andere umgewandelt wird, ohne die DNA zu zerstören. Doch auch diese Technik hatte ihre Grenzen. Sie ist nicht nur auf die Umwandlung von C in T beschränkt, sondern vor allem auf das TC-Motiv, so dass es sich praktisch um einen TC-TT-Konverter handelt. Dies bedeutet, dass sie nur 9 von 90 (= 10 %) bestätigten pathogenen mitochondrialen Punktmutationen korrigieren kann. Lange Zeit galt die A-zu-G-Umwandlung der mitochondrialen DNA als unmöglich.
Der Erstautor CHO Sung-Ik sagte: "Wir begannen, über Möglichkeiten nachzudenken, diese Einschränkungen zu überwinden. So konnten wir eine neuartige Gene-Editing-Plattform namens TALED entwickeln, mit der eine A-zu-G-Umwandlung möglich ist. Unser neuer Basen-Editor erweitert die Möglichkeiten der mitochondrialen Genom-Editierung dramatisch. Dies kann einen großen Beitrag nicht nur zur Erstellung eines Krankheitsmodells, sondern auch zur Entwicklung einer Behandlung leisten. Bemerkenswert ist, dass allein durch die Möglichkeit, A-zu-G-Umwandlungen in der menschlichen mtDNA durchzuführen, 39 (= 43 %) der 90 bekannten pathogenen Mutationen korrigiert werden könnten.
Die Forscher schufen TALED, indem sie drei verschiedene Komponenten miteinander verschmolzen. Die erste Komponente ist ein Transkriptionsaktivator-ähnlicher Effektor (TALE), der in der Lage ist, eine DNA-Sequenz anzusteuern. Die zweite Komponente ist TadA8e, eine Adenin-Desaminase, die die Umwandlung von A nach G erleichtert. Die dritte Komponente, DddAtox, ist eine Cytosin-Desaminase, die die DNA für TadA8e leichter zugänglich macht.
Ein interessanter Aspekt von TALED ist die Fähigkeit von TadA8e, A-zu-G-Editing in Mitochondrien durchzuführen, die doppelsträngige DNA (dsDNA) besitzen. Dies ist ein rätselhaftes Phänomen, da TadA8e ein Protein ist, von dem bekannt ist, dass es nur für einzelsträngige DNA spezifisch ist. Direktor Kim sagte: "Niemand hat bisher daran gedacht, TadA8e für das Base Editing in Mitochondrien zu verwenden, da es nur für einzelsträngige DNA spezifisch sein soll. Dieser unkonventionelle Ansatz hat uns bei der Entwicklung von TALED wirklich geholfen."
Die Forscher stellten die Theorie auf, dass DddAtox die dsDNA zugänglich macht, indem es den Doppelstrang vorübergehend abwickelt. Dieses flüchtige, aber vorübergehende Zeitfenster ermöglicht es TadA8e, einem sehr schnell wirkenden Enzym, die notwendigen Änderungen vorzunehmen. Die Forscher haben nicht nur die Komponenten von TALED optimiert, sondern auch eine Technologie entwickelt, die sowohl die gleichzeitige Bearbeitung von A-zu-G- und C-zu-T-Basen als auch die Bearbeitung nur von A-zu-G-Basen ermöglicht.
Die Gruppe demonstrierte diese neue Technologie, indem sie einen aus einer einzigen Zelle stammenden Klon erzeugte, der die gewünschten mtDNA-Editierungen enthielt. Darüber hinaus wurde festgestellt, dass TALEDs weder zytotoxisch sind noch Instabilität in der mtDNA verursachen. Auch gab es keine unerwünschten Off-Target-Editierungen in der Kern-DNA und nur sehr wenige Off-Target-Effekte in der mtDNA. Die Forscher wollen nun die TALEDs weiter verbessern, indem sie die Effizienz und Spezifität der Editierung erhöhen, um schließlich den Weg für die Korrektur krankheitsverursachender mtDNA-Mutationen in Embryonen, Föten, Neugeborenen oder erwachsenen Patienten zu ebnen. Die Gruppe konzentriert sich auch auf die Entwicklung von TALEDs, die für das A-zu-G-Basen-Editing in der Chloroplasten-DNA geeignet sind, die wesentliche Gene für die Photosynthese in Pflanzen kodiert.
William I. Suh, der Wissenschaftskommunikator am Institut für Grundlagenforschung, erklärte: "Ich glaube, die Bedeutung dieser Entdeckung ist vergleichbar mit der Erfindung der blauen LED, die 2014 mit dem Nobelpreis ausgezeichnet wurde. So wie die blaue LED das letzte Teil des Puzzles war, das uns eine hoch energieeffiziente Quelle für weißes LED-Licht ermöglichte, so wird erwartet, dass TALED eine neue Ära des Genome Engineering einleiten wird."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.