Lockdown für Tumorzellen
Neuartiger Inhibitor macht Tumorzellen unbeweglich
Proteinphosphatasen sind die Gegenspieler der Proteinkinasen, zusammen steuern diese beiden Enzymgruppen praktisch jeden Aspekt des Zellverhaltens. Daher ist die Möglichkeit, in die Aktivität spezifischer Kinasen oder Phosphatasen einzugreifen, die Grundlage für eine wachsende Zahl medizinischer Behandlungen, von der Unterdrückung von Entzündungen bei Organtransplantationen bis hin zur Therapie von Leukämie. Ein neuartiger Inhibitor, der an der Universität Konstanz entdeckt wurde, schaltet in Tumorzellen ein entscheidendes Enzym aus, eine Proteinphosphatase, so dass diese Zellen nicht mehr beweglich sind. Dieser zelluläre Lockdown verhindert, dass Tumorzellen in gesundes Gewebe eindringen, und könnte dadurch mithelfen, Metastasen zu unterdrücken. Die Ergebnisse wurden am 19. April 2022 in der Online-Ausgabe von „Cell Chemical Biology“ veröffentlicht.
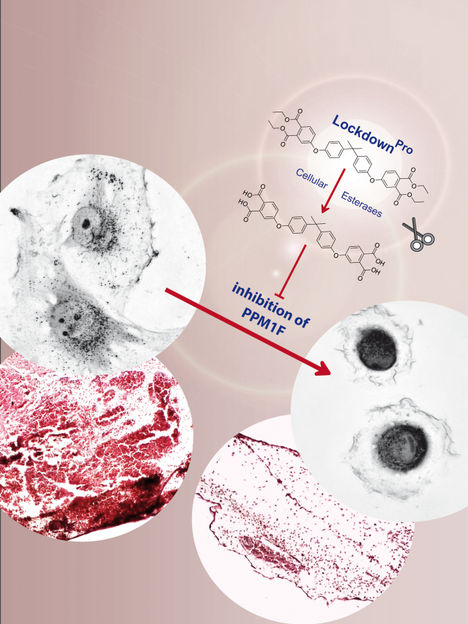
Mit seiner selektiven Hemmung der Proteinphosphatase PPM1F stoppt Lockdown die Tumorzellinvasion
Tanja Grimm und Marleen Herbinger, Universität Konstanz
Alle zellulären Prozesse in unserem Körper, einschließlich Wachstum, Vermehrung, Differenzierung und Migration, hängen vom Zusammenspiel zwischen Proteinkinasen und Proteinphosphatasen ab, von Enzymen also, die den Grad der Phosphorylierung anderer Proteine und damit deren Funktion regulieren. Wenn die Phosphorylierung von Schlüsselproteinen außer Kontrolle gerät, hat dies schwerwiegende Folgen für die Zellen. Es überrascht deshalb nicht, dass eine gestörte Proteinphosphorylierung eines der Hauptmerkmale von Krebszellen ist.
Dementsprechend haben niedermolekulare Blocker dieser Enzyme, insbesondere Kinaseinhibitoren, die Tumorbehandlung revolutioniert. Phosphatasen stellen im Prinzip ebenfalls vielversprechende Zielmoleküle dar, aber diese Enzymgruppe war bisher nur schwer mit solchen Inhibitoren zu erreichen. Der vom Forschungsteam von Christof Hauck, Professor für Zellbiologie, nun identifizierte spezifische Hemmstoff zielt auf die Proteinphosphatase PPM1F ab, die eine wichtige Rolle bei der Zellfortbewegung spielt. In der Tat sind die mit dem Inhibitor behandelten Zellen nicht mehr beweglich, sodass die Tumorzellen an Ort und Stelle verharren.
Die Entwicklung spezifischer Hemmstoffe für Proteinphosphatasen ist eine harte Nuss für Biochemiker. Dies ist zumindest teilweise auf das flache und unscheinbare reaktive Zentrum der meisten Proteinphosphatasen zurückzuführen, das keine prägnante Bindungsstelle für Inhibitoren bietet. Die besten Chancen auf einen spezifischen Effekt erhält man deshalb mit Hemmstoffen, welche die Enzymaktivität quasi aus der Distanz beeinflussen, sogenannte allosterische Inhibitoren. Doch einen solchen Wirkstoff zu finden, ist die Suche nach der sprichwörtlichen Nadel im Heuhaufen.
Mit großen Zahlen den Zufall erzwingen
Um eine Verbindung mit diesen besonderen Eigenschaften zu finden, hat sich Tanja Grimm, Doktorandin in der Gruppe von Christof Hauck und Mitglied der Konstanzer Research School Chemical Biology, mit dem Screening Center des Fachbereichs Biologie zusammengetan. Ziel war es, von aufwändigen biochemischen Tests der Enzymaktivität zu einem automatisierten Verfahren im Miniatur-Maßstab überzugehen. Tatsächlich gelang es Tanja Grimm gemeinsam mit dem Screening Center, mehr als 55.000 Verbindungen zu testen, einen chemisch-informatischen Algorithmus zur Selektion vielversprechender Substanzen zu entwickeln, 200 Kandidaten wiederholt zu bewerten und schließlich eine Handvoll von PPM1F-Inhibitoren zu finden.
Diese Moleküle waren zwar alle in der Lage, das gereinigte Enzym zu blockieren, aber nur eine Verbindung zielte ausschließlich auf PPM1F, während die übrigen eine unerwünschte hemmende Aktivität auch für andere Enzyme aufwiesen. Dieser selektive PPM1F-Inhibitor hatte allerdings auch einen Nachteil: Er hatte polare Gruppen, die eine Passage durch die Zellmembran problematisch machen, sodass der Inhibitor das Zielenzym im Zellinneren kaum erreichen konnte. Tanja Grimm synthetisierte daher gemeinsam mit einer Kollegin aus dem Fachbereich Chemie eine modifizierte Version der Verbindung, die sie dann an intakten Zellen testen konnte.
Tumorzellen an Ort und Stelle halten
Da PPM1F in bösartigen Tumoren oft in großen Mengen vorkommt, lag es nahe, die Aktivität des PPM1F-Inhibitors in menschlichen Krebszellen zu testen. Zuvor war bereits gezeigt worden, dass die genetische Deletion von PPM1F, d.h. die Entfernung des PPM1F-Gens aus der DNA, zu unbeweglichen Zellen führt. Die Anwendung des Inhibitors erzeugt einen ähnlichen Phänotyp: Die Zellen klebten fest am Substrat und bewegten sich nicht mehr fort. Um diese besondere Eigenschaft hervorzuheben, tauften die Forscher*innen ihren neuen Hemmstoff in „Lockdown“ um, da er die hohe Beweglichkeit von Tumorzellen unterbindet.
Das Team testete dann, ob Lockdown auch Tumorzellen daran hindern würde, durch Gewebebarrieren zu wandern, ein Prozess, der als „Tumorzellinvasion" bezeichnet wird. Die Tumorzellinvasion steht im Zusammenhang mit der Fähigkeit von Tumorzellen, Metastasen an entfernten Stellen im Körper zu bilden, und ist eines der entscheidenden Merkmale bösartiger Zellen. In der Tat konnte Lockdown verhindern, dass menschliche Glioblastomzellen, eine sehr invasive Form von Hirntumorzellen, Gewebebarrieren überwinden und in gesundes Gewebe eindringen. Demnach könnten Substanzen wie Lockdown als Ausgangspunkt für die Entwicklung von Wirkstoffen dienen, um die Metastasierung zu blockieren.
PPM1F-Substrate sind entscheidend für die Invasion von Tumorzellen
Die Möglichkeit, PPM1F durch pharmakologische Hemmung zu kontrollieren, eröffnet nun auch einen neuen Weg zur Untersuchung dieses interessanten Enzyms. Offenbar müssen die Substrate von PPM1F entscheidende Regulatoren für die Beweglichkeit und Invasion von Tumorzellen sein. Die Forscherinnen und Forscher hoffen nun, dass ihre Arbeit es ermöglicht, alle diese nachgeschalteten Substrate aufzuklären, um weitere Ziele für künftige Metastasen-Blocker zu finden. „Es mag noch ein ferner Traum sein, aber die Möglichkeit, die Metastasierung von Tumoren zu stoppen, wäre ein wesentlicher Fortschritt. Gerade in Situationen, in denen der Primärtumor chirurgisch entfernt werden kann, hängt das mögliche Auftreten von Metastasen wie ein Damoklesschwert über den Patienten", sagt Tanja Grimm, Erstautorin der Studie.