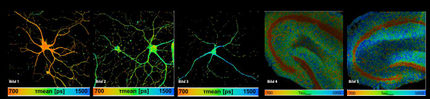
Rotierendes blaues Laserlicht macht ungeahnte Dynamiken in lebenden Zellen sichtbar
Wissenschaftler entdecken mit neuem Laserscan-Mikroskop Vorgänge in Zellen, die sich auf der Millisekunden-Skala ändern
Wenn Großstädte sich bei Einbruch der Dunkelheit in eine bunte Lichterwelt verwandeln, lassen sie oft nur noch die Umrisse der Stadt erkennen, die die Aufmerksamkeit je nach Blickwinkel auf Wesentliches oder Unwesentliches lenken. In der Fluoreszenzmikroskopie werden biologische Zellen mit Fluoreszenzfarbstoffen markiert und per Lichtschaltung in bestimmten Bereichen zum Leuchten gebracht – wie eine Stadt bei Nacht. Allerdings ist dieses Leuchten für kleine, schnelle Objekte meist zu dunkel oder erlischt nach einiger Zeit, was man Fluoreszenzbleichung nennt. Mit einem neuen, im Labor für Bio- und Nano-Photonik der Universität Freiburg von Prof. Dr. Alexander Rohrbach entwickelten Ansatz haben er und sein Team einen Weg gefunden, kleinste Objekte ohne Fluoreszenz äußerst scharf sichtbar zu machen. Hierbei können zelluläre Strukturen oder virenartige Partikel 100- bis 1.000-mal länger, zehn- bis 100-mal schneller und mit nahezu doppelter Auflösung beobachtet werden als mit Fluoreszenzmikroskopie. Während Fluoreszenzmikroskopie „Nachtbilder“ von Strukturen aufzeichnet, nimmt ROCS-Mikroskopie die „Tagbilder“ auf – Gegensätze, die sich ausgezeichnet kombinieren lassen. Verschiedene Anwendungen des Verfahrens beschreiben die Wissenschaftler*innen um Rohrbach in der aktuellen Ausgabe der Fachzeitschrift Nature Communications.
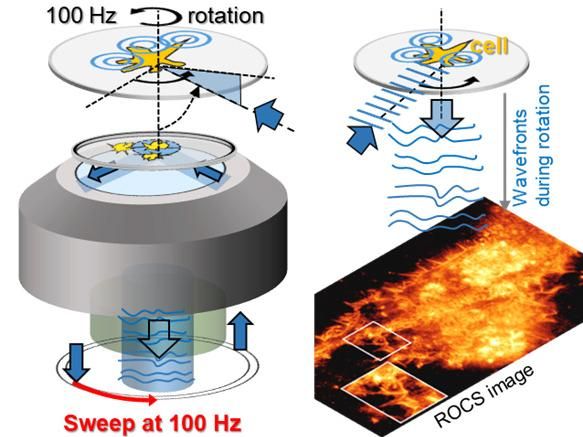
Blaue Laserstrahlen rotieren unter verschiedenen Winkeln 100 mal pro Sekunde um das Objekt (Schema links). Die an den Zellstrukturen (cell) gestreuten Lichtwellen erzeugen so 100 superaufgelöste Bilder pro Sekunde. Innerhalb einer 10ms langen Umdrehung (0-360°), erzeugen kontinuierlich deformierte Lichtwellen das gestochen scharfe Bild einer Zelle aus reinem Laserstreulicht, wie im Foto darunter zu erkennen.
AG Rohrbach
Blauer Laser wird schräg auf Objekt gerichtet
Die verwendete Technik heißt „Rotating Coherent Scattering“ (ROCS) und basiert auf einem blauen, schnell rotierenden Laserstrahl. „Wir nutzen hierbei mehrere aus dem Alltag bekannte physikalische Phänomene“, erklärt Rohrbach: „Erstens, dass kleine Objekte wie Moleküle, Viren oder Zellstrukturen blaues Licht am stärksten streuen, also verteilen, wie man es von den Luftmolekülen in der Atmosphäre kennt und was als blauer Himmel wahrgenommen wird.“ Kleine Objekte streuen und lenken etwa zehnmal mehr blaue als rote Lichtteilchen zur Kamera und übermitteln dadurch wertvolle Informationen.
Zweitens wird bei ROCS ein blauer Laser sehr schräg auf die biologischen Objekte gerichtet, weil dies Kontrast und Auflösung deutlich erhöht. Auch das ist aus dem Alltag bekannt: Bei einem schräg gegen das Licht gehaltenem Weinglas sind Schmutz oder Fingerabdrücke darauf besser erkennbar. Drittens beleuchten die Wissenschaftler*innen das Objekt nacheinander von allen Seiten mit dem schrägen Laserstrahl, weil nur eine Beleuchtungsrichtung alleine viele Artefakte erzeugen würde.
100 Bilder pro Sekunde von lebenden Zellen
Die Freiburger Physiker und Ingenieure vom Institut für Mikrosystemtechnik (IMTEK) lassen den schrägen Laserstrahl hundertmal pro Sekunde um das Objekt rotieren und erzeugen so 100 Bilder pro Sekunde. „In zehn Minuten habe wir also bereits 60.000 Bilder von lebenden Zellen, welche sich viel dynamischer präsentieren, als bisher angenommen“, sagt Rohrbach. Allerdings erfordern solche Dynamikanalysen von bereits nur einer Minute Bildmaterial enorme Rechenleistungen von Computern. Hierbei mussten verschiedene Computeralgorithmen und Analyseverfahren erst noch entwickelt werden, um die Daten richtig interpretieren zu können.
Zusammen mit seinem Mitarbeiter Dr. Felix Jünger und in Kooperation mit verschiedenen Freiburger Forschungsgruppen konnte Rohrbach die Leistungsfähigkeit des Mikroskops an verschiedenen Zellsystemen demonstrieren: „Es war nicht unser primäres Ziel, schöne Bilder oder Filme von der unerwartet hohen Dynamik von Zellen zu erzeugen – wir wollten neue biologische Erkenntnisse gewinnen.” So konnte mit der ROCS-Technik erstmalig beobachtet werden, wie stimulierte Mastzellen in nur wenigen Millisekunden kleine Poren öffnen, um kugelartige Granulen mit unerklärlich hoher Kraft und Geschwindigkeit herauszuschießen. Die Granulen enthalten den Botenstoff Histamin, welcher später zu allergischen Reaktionen führen kann.
Anbindungsverhalten von virenartigen Partikeln beobachtet
In einer anderen Experimentserie konnten die Forscher beobachten, wie winzige, virenartige Partikel in aberwitzigem Tempo um die zerklüftete Oberfläche von Fresszellen tanzen, um nach einigen Versuchen einen Anbindungspunkt an der Zelle zu finden. Diese Beobachtungen dienten als Vorversuche zu derzeit laufenden Studien zum Anbindungsverhalten des Coronavirus.
Außerdem wurde die ROCS-Technologie im Rahmen des Verbundprojekts SFB 1425 eingesetzt, um Narbenbildung bei Herzmuskelverletzungen zu untersuchen. Fibroblasten, also Zellen des Narbengewebes, bilden 100 Nanometer dünne Röhrchen aus, so genannte Nano-Tubes, die 1.000-mal dünner sind als ein Haar. Durch die neue Technik konnten Jünger und Rohrbach entdecken, dass diese Tubes auf winzigen Skalen thermisch vibrieren, diese Bewegung aber mit der Zeit nachlässt. Nach mathematischen Aktivitätsanalysen lässt sich hier eine mechanische Versteifung der Nano-Tubes vermuten.
In weiteren Experimenten konnten die Wissenschaftler schließlich über viele tausend Bilder hinweg beobachten, wie die Filopodien – die „Finger“ von Fresszellen – in einer komplexen Zitterbewegung ihre Umgebung nach Beute abtasten und sich ihr Zytoskelett in einem bisher nicht bekannten Tempo verändern kann.
Originalveröffentlichung
Jünger, F., Ruh, D., Strobel, D., Michiels, R., Huber, D., Brandel, A., Madl, J., Gavrilov, A., Mihlan, M., Daller, C. C., Rog-Zielinska, E.A., Römer, W., Lämmermann, T.,Rohrbach, A. (2022): 100 Hz ROCS microscopy correlated with fluorescence reveals cellular dynamics on different spatiotemporal scales. In: Nature Communications 13(1): 1758.
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Zellanalyse
Die Zellanalyse ermöglicht es uns, Zellen in ihren vielfältigen Facetten zu erforschen und zu verstehen. Von der Einzelzellanalyse über die Durchflusszytometrie bis hin zur Bildgebungstechnologie – die Zellanalyse bietet uns wertvolle Einblicke in die Struktur, Funktion und Interaktion von Zellen. Ob in der Medizin, der biologischen Forschung oder der Pharmakologie – die Zellanalyse revolutioniert unser Verständnis von Krankheiten, Entwicklung und Behandlungsmöglichkeiten.
Themenwelt Zellanalyse
Die Zellanalyse ermöglicht es uns, Zellen in ihren vielfältigen Facetten zu erforschen und zu verstehen. Von der Einzelzellanalyse über die Durchflusszytometrie bis hin zur Bildgebungstechnologie – die Zellanalyse bietet uns wertvolle Einblicke in die Struktur, Funktion und Interaktion von Zellen. Ob in der Medizin, der biologischen Forschung oder der Pharmakologie – die Zellanalyse revolutioniert unser Verständnis von Krankheiten, Entwicklung und Behandlungsmöglichkeiten.