Methanfressende Bakterien wandeln Treibhausgas in Kraftstoff um
Modernste Methode enthüllt nie zuvor gesehene atomare Strukturen, die den Prozess steuern
Methanotrophe Bakterien verbrauchen jährlich 30 Millionen Tonnen Methan und faszinieren die Forscher durch ihre natürliche Fähigkeit, das starke Treibhausgas in nutzbaren Brennstoff umzuwandeln. Dennoch wissen wir nur sehr wenig darüber, wie diese komplexe Reaktion abläuft, was unsere Möglichkeiten einschränkt, den doppelten Nutzen zu unserem Vorteil zu nutzen.
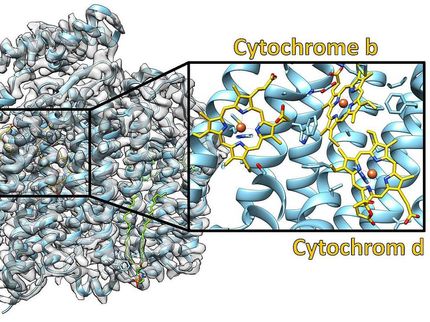
Die Kryo-EM beleuchtete nie zuvor gesehene Strukturen in der Membran des Proteins.
Northwestern University
Durch die Untersuchung des Enzyms, das die Bakterien zur Katalyse der Reaktion verwenden, hat ein Team der Northwestern University nun Schlüsselstrukturen entdeckt, die den Prozess steuern könnten.
Ihre Ergebnisse, die am Freitag (18. März) in der Fachzeitschrift Science veröffentlicht wurde, könnten letztlich zur Entwicklung von biologischen Katalysatoren für den Menschen führen, die Methangas in Methanol umwandeln.
"Methan hat eine sehr starke Bindung, daher ist es ziemlich bemerkenswert, dass es ein Enzym gibt, das dies tun kann", sagte Amy Rosenzweig von Northwestern, Hauptautorin der Studie. "Wenn wir nicht genau verstehen, wie das Enzym diese schwierige Chemie durchführt, werden wir nicht in der Lage sein, es für biotechnologische Anwendungen zu entwickeln und zu optimieren.
Rosenzweig ist die Weinberg Family Distinguished Professor of Life Sciences am Weinberg College of Arts and Sciences von Northwestern, wo sie sowohl einen Lehrstuhl für molekulare Biowissenschaften als auch für Chemie innehat.
Das Enzym, die partikuläre Methanmonooxygenase (pMMO), ist ein besonders schwer zu untersuchendes Protein, da es in die Zellmembran der Bakterien eingebettet ist.
Wenn Forscher diese methanotrophen Bakterien untersuchen, wenden sie normalerweise ein raues Verfahren an, bei dem die Proteine mit einer Detergenzlösung aus den Zellmembranen herausgerissen werden. Dieses Verfahren isoliert zwar effektiv das Enzym, tötet aber auch die gesamte Enzymaktivität ab und schränkt die Möglichkeiten der Forscher ein, Informationen zu sammeln - wie bei der Überwachung eines Herzens ohne Herzschlag.
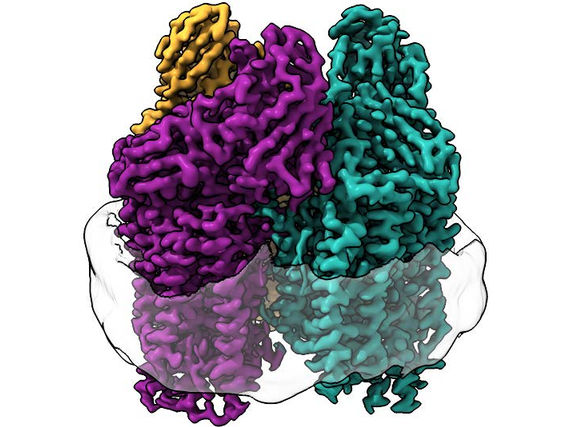
In dieser Studie verwendete das Team eine völlig neue Technik. Christopher Koo, Erstautor und Doktorand in Rosenzweigs Labor, fragte sich, ob man etwas Neues erfahren könnte, wenn man das Enzym wieder in eine Membran einsetzt, die seiner natürlichen Umgebung ähnelt. Koo verwendete Lipide aus den Bakterien, um eine Membran in einem schützenden Partikel, einer so genannten Nanodisk, zu bilden, und bettete dann das Enzym in diese Membran ein.
"Indem wir die ursprüngliche Umgebung des Enzyms in der Nanodisc wiederherstellten, konnten wir die Aktivität des Enzyms wiederherstellen", sagte Koo. "Anschließend konnten wir mit Hilfe von Strukturtechniken auf atomarer Ebene bestimmen, wie die Lipid-Doppelschicht die Aktivität wiederherstellt. Auf diese Weise entdeckten wir die vollständige Anordnung der Kupferstelle im Enzym, an der die Methanoxidation wahrscheinlich stattfindet.
Die Forscher verwendeten die Kryo-Elektronenmikroskopie (Kryo-EM), eine Technik, die sich gut für Membranproteine eignet, da die Lipidmembranumgebung während des gesamten Experiments ungestört ist. Dadurch konnten sie zum ersten Mal die atomare Struktur des aktiven Enzyms in hoher Auflösung sichtbar machen.
"Als Folge der jüngsten 'Auflösungsrevolution' in der Kryo-EM waren wir in der Lage, die Struktur im atomaren Detail zu sehen", so Rosenzweig. "Was wir sahen, hat unsere Vorstellungen vom aktiven Zentrum dieses Enzyms völlig verändert."
Rosenzweig sagte, dass die Kryo-EM-Strukturen einen neuen Ausgangspunkt für die Beantwortung der Fragen bieten, die sich weiterhin auftürmen. Wie gelangt das Methan zum aktiven Zentrum des Enzyms? Oder wie kommt das Methanol aus dem Enzym heraus? Wie führt das Kupfer im aktiven Zentrum die chemische Reaktion durch? Als Nächstes plant das Team, das Enzym direkt in der Bakterienzelle zu untersuchen, und zwar mit einem bildgebenden Verfahren namens Kryo-Elektronentomographie (Kryo-ET).
Wenn dies gelingt, werden die Forscher in der Lage sein, genau zu sehen, wie das Enzym in der Zellmembran angeordnet ist, zu bestimmen, wie es in seiner natürlichen Umgebung funktioniert, und zu erfahren, ob andere Proteine in der Umgebung des Enzyms mit ihm interagieren. Diese Entdeckungen würden den Ingenieuren ein wichtiges fehlendes Bindeglied liefern.
"Wenn man das Enzym optimieren will, um es in biologische Produktionswege einzubinden oder um andere Schadstoffe als Methan zu verbrauchen, müssen wir wissen, wie es in seiner natürlichen Umgebung aussieht und wo das Methan bindet", so Rosenzweig. "Man könnte Bakterien mit einem gentechnisch veränderten Enzym verwenden, um Methan aus Fracking-Anlagen zu gewinnen oder um Ölverschmutzungen zu beseitigen.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.