Pop-up-Fabriken hinter der Zellmembran
Lange betrachtete man das Zellinnere als ein großes „Schwimmbecken“, in dem sich alles frei tummelt: Doch es scheint bislang unbekannte Strukturen zu geben
Wie eine Zelle hunderte Signale gleichzeitig verarbeiten kann, zeigen MDC-Forschende im Fachblatt „Cell“. Andreas Bock und seine Kolleg*innen gehen davon aus, dass sich mit den Ergebnissen ein komplett neues Forschungsfeld in der Zellbiologie öffnen wird.
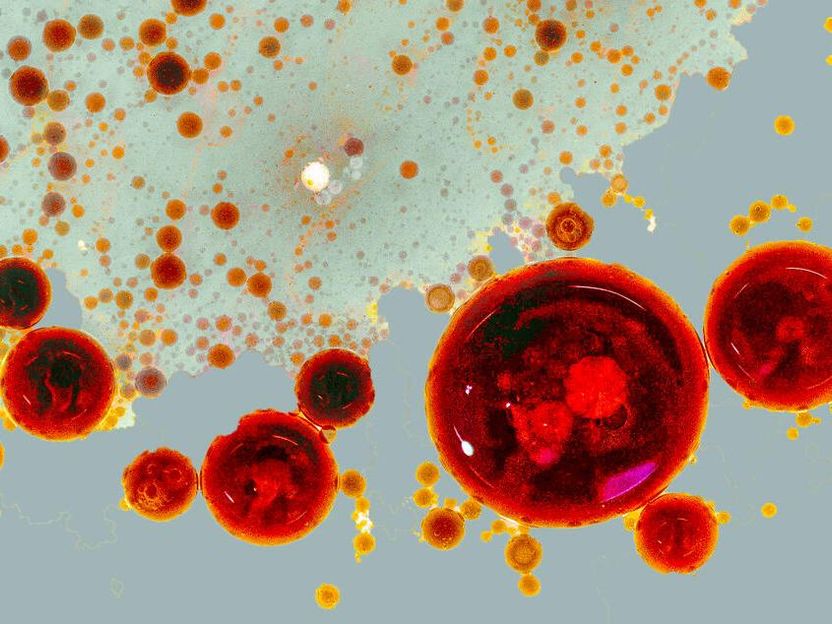
Das Bild ist eine Fotografie einer Vinaigrette. Die Öltropfen symbolisieren die Pop-up-Fabriken (RAINs). Je nach Signalstärke können RAINs verschiedene Größen annehmen und auch fusionieren, um dann globale Zellantworten auszulösen.
© Lisa Maria Martin, Charlotte Kayser, MDC
Eine lebende Zelle ist vielfältigen Reizen ausgesetzt. Unzählige Botenstoffe docken an ihrer Oberfläche an und lösen Signalkaskaden im Zellinneren aus. Daraufhin stellt die Zelle Substanzen her, baut sie ab oder schaltet Gene im Zellkern ein oder aus. Rezeptoren in der Zellmembran nehmen die Informationen für all diese „Aufträge“ an. Soweit, so klar. Aber was passiert da eigentlich genau? Forschende am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) fanden nun heraus, dass die Vorgänge weit komplexer sind als bisher angenommen. Andreas Bock ist Letztautor der Studie in „Cell“ und leitete bis vor Kurzem die MDC-Arbeitsgruppe „Signalprozesse von Rezeptoren“. Er ist jetzt Professor an der Universität Leipzig.
Es gibt über 800 unterschiedliche G-Protein-gekoppelte Rezeptoren. Sie bilden die wichtigste Gruppe von Membranproteinen. Auf einer einzelnen Zelle können bis zu hundert verschiedene davon sitzen und diese sprechen wiederum auf ganz unterschiedliche äußere Botenstoffe an. „Von außen haben wir also höchste Spezifität, doch in der Zelle gibt es nur eine Handvoll Moleküle, die auf die Aktivierung reagieren. Dennoch erledigen sie vielfältige und völlig unterschiedliche Aufgaben“, sagt Bock. Wie das funktionieren kann, darüber rätselt die Wissenschaft schon lange.
Kommunikation in nanometergroßen Räumen
Eines dieser Arbeitsmoleküle ist Cyclisches Adenosinmonophosphat (cAMP). Ein Beispiel: Regt man Herzmuskelzellen mit Adrenalin an, erhöht sich der cAMP-Spiegel und das Herz kontrahiert schneller und kräftiger. Werden die gleichen Zellen mit Prostaglandin stimuliert, entsteht zwar die gleiche Menge cAMP – aber der Herzmuskel reagiert kaum.
Mit Fluoreszenzmikroskopie untersuchten die Forschenden an isolierten Einzelzellen, wie die cAMP-Signale von zwei verschiedenen Rezeptoren parallel in einer Zelle entstehen und verarbeitet werden. Einer der Rezeptoren ist wichtig für die Insulinausschüttung, der andere beeinflusst die Herz- und Lungenfunktion. Sie erkannten, dass sich direkt am aktivierten Rezeptor winzig kleine Domänen mit einem Radius zwischen 30 und 60 Nanometern bilden.
Bock vergleicht die Nanoräume mit Pop-up-Fabriken, die an der Zellmembran entstehen und die in dem Moment anfangen zu arbeiten, wenn ein „Auftrag“ hereinkommt. „Wenn so ein Nanoraum gefüllt ist, schwappt das cAMP über in den nächsten, und so triggert sich die Signalkaskade quasi herunter in das Zellinnere.“
Die Entdeckung der Nanodomänen erhöhe die Komplexität von Signalwegen in der Zelle um ein Vielfaches, sagt Dr. Charlotte Kayser. Gemeinsam mit Dr. Selma Anton, ehemalige Doktorandin am MDC, und Dr. Isabella Maiellaro von der Universität Nottingham, ebenfalls eine frühere Kollegin aus der AG, ist sie Erstautorin der Studie. „Signale, die am Rezeptor entstehen, bleiben erst einmal vor Ort und beeinflussen auch nur die Enzyme in unmittelbarer Umgebung. Andere Bereiche in der Zelle werden durch sie also nicht angesprochen. Dadurch können Signalwege sehr präzise ein- und ausgeschaltet werden.“
Lange betrachtete die Wissenschaft das Cytosol, das Innere der Zelle, als ein großes „Schwimmbecken“, in dem sich alles frei tummelt. Doch es scheint bislang unbekannte Strukturen zu geben, die die MDC-Forschenden nun als Signal-Nanoarchitektur bezeichnen, und die je nach Bedarf angeschaltet wird. „Wir können die Nanoräume noch nicht visualisieren“, sagt Bock. Er vermutet aber, dass eine gelartige Struktur das cAMP daran hindert, aus den winzigen Räumen heraus zu diffundieren. Dies könnten zum Beispiel große Gerüstproteine sein oder cAMP-abbauende Enzyme, die dafür sorgen, dass eine Grenze zwischen dem Raum mit hoher cAMP-Konzentration und dem Cytosol entsteht.
Was bedeutet diese Entdeckung für die Zellbiologie?
Die Zelle ist demnach anscheinend kein Schalter, der entweder „An“ oder „Aus“ ist. Sie funktioniere eher wie ein Chip, bei dem auf kleinster Fläche viele Signale gleichzeitig verarbeitet werden, erklärt Letztautor und Initiator der Projektes Professor Martin Lohse vom ISAR Bioscience Institute in München. „Das ist zum Beispiel sehr wichtig für Nervenzellen, die auf diese Weise an ihren Ausläufern jeweils unterschiedliche Signale verarbeiten können: Eine Stelle kann stimuliert sein, eine weitere ruhen und eine dritte gehemmt werden“, sagt er.
Welche Auswirkungen diese Entdeckung für die Medizin haben wird, ist noch nicht absehbar. Es werde sich auf jeden Fall ein neues Forschungsfeld öffnen, vermutet Bock. Künftige Wirkstoffe könnten einzelne Bestandteile der Nanodomänen gezielt angreifen und somit viel präziser wirken oder auch geringere Nebenwirkungen haben.
Gaben die Forschenden nur wenig Botenstoff auf die Zelle, waren die Nanodomänen stark ausgeprägt. Bei höheren Konzentrationen begannen die Räume zu verschmelzen. Auch das ließe sich medizinisch nutzen. „Es könnte bedeuten, dass man mit Substanzen, die in unterschiedlichem Maße Rezeptoren stimulieren – wie das zum Beispiel verschiedene Opioide tun –, nicht nur quantitativ, sondern auch qualitativ unterschiedliche Effekte erzeugen kann. Je nachdem, ob die ausgelösten cAMP-Signale in der Zelle lokal begrenzt bleiben oder die ganze Zelle erfassen“, ergänzt Martin Lohse.
Zunächst gilt es jedoch, den Aufbau der Nanodomänen besser zu verstehen. Erste Befunde deuten darauf hin, dass ihre Ausbildung bei kranken Zellen, wie Leberkrebszellen oder Herzmuskelzellen von Patientinnen und Patienten mit Herzinsuffizienz, nicht mehr funktioniert.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.