Auffahrunfall auf der „Ribosomen-Autobahn“
Wissenschaftler identifizieren bakterielles Protein, das „stehengebliebene“ Ribosomen erkennt und rettet
Als molekulare Maschine, die in den Zellen aller Organismen vorkommt, ist das Ribosom für die Herstellung neuer Proteine zuständig. Hierfür liest es auf einem Botenmolekül – der messenger RNA (mRNA) – den Bauplan für ein bestimmtes Protein ab und setzt diese Informationen anschließend in neue Eiweiße um. Aus verschiedenen Gründen kann dieser Prozess fehlschlagen, wodurch das Ribosom auf der mRNA „stehenbleibt“ und die Proteinherstellung ins Stocken gerät. Ein internationales Forschungsteam unter Leitung von Wissenschaftlern des Zentrums für Molekulare Biologie der Universität Heidelberg (ZMBH) hat nun ein bakterielles Protein namens MutS2 identifiziert, das solche festsitzenden Proteinfabriken erkennt und rettet. Die Kollision mit dem nachfolgenden Ribosom auf der mRNA spielt dabei eine zentrale Rolle.
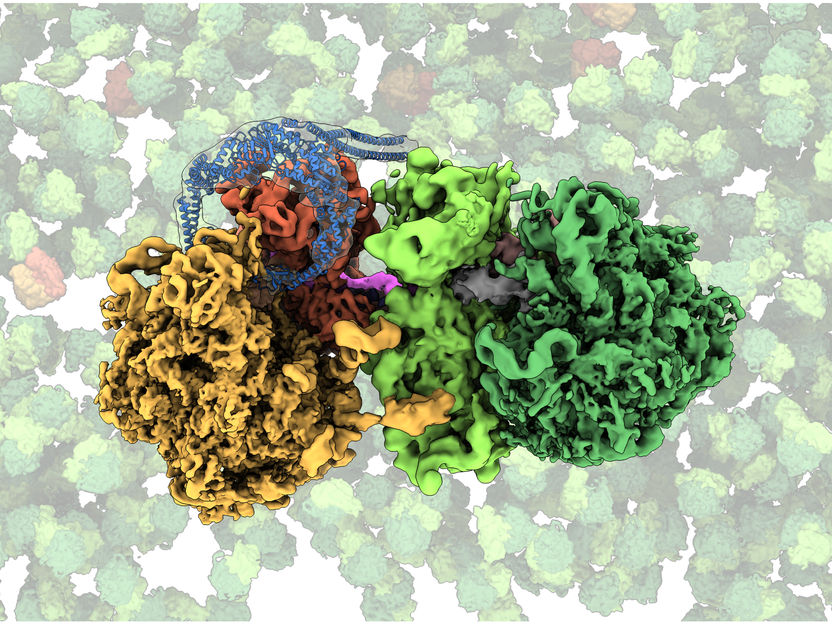
Kryo-EM-Struktur der kollidierten Ribosomen mit MutS2. Die verschiedenen molekularen Bestandteile wurden unterschiedlich eingefärbt (stehengebliebenes Ribosom: orange; kollidiertes Ribosom: grün; MutS2: blau; mRNA: pink).
Sebastian Filbeck (ZMBH)
Die Baupläne von Proteinen sind in der DNA im Zellkern gespeichert und werden dort in mRNA umgeschrieben. Mit den genetischen Informationen für ein bestimmtes Protein verlässt die mRNA den Zellkern und wird zu den Ribosomen transportiert, wo diese Informationen in Eiweiße umgesetzt werden. „Beim Ablesen dieser Baupläne können Ribosomen ins Stocken geraten, etwa wegen eines defekten mRNA-Moleküls. Das ist vor allem deshalb problematisch, weil unfertige Proteine potenziell giftig für die Zelle sind“, erklärt der Molekularbiologe Prof. Dr. Claudio Joazeiro, der mit seiner Arbeitsgruppe am ZMBH forscht. „Aus diesem Grund haben Zellen Mechanismen entwickelt, die stehengebliebene Ribosomen erkennen und die unfertigen Proteine für den Abbau markieren, solange sie sich noch an ihrem Geburtsort, dem Ribosom, befinden.“
Einen zentralen Schritt in diesem Prozess haben die Wissenschaftler anhand des weitverbreiteten Bodenbakteriums Bacillus subtilis mithilfe von hochauflösender Kryo-Elektronenmikroskopie entschlüsselt. Sie konnten genau charakterisieren, wie das Protein MutS2, das in etwa einem Drittel aller Bakterienarten vorkommt, seine Aufgabe als Sensor für stehengebliebene Ribosomen erfüllt: MutS2 erkennt die Kollision zwischen dem festsitzenden und nachfolgenden Ribosom auf der mRNA – ein Vorgang, der nach den Worten von Dr. Stefan Pfeffer, Nachwuchsgruppenleiter am ZMBH, große Ähnlichkeit mit einem Auffahrunfall hat, der durch ein liegengebliebenes Fahrzeug auf der Autobahn verursacht wird und dadurch die Aufmerksamkeit der Polizei erregt.
Um auf der mRNA verharrende Ribosomen zu retten, verfolgt MutS2 nach Angaben der Wissenschaftler zwei unabhängige Strategien. „Einerseits zerschneidet MutS2 das mRNA-Molekül, damit es abgebaut werden kann. Andererseits trennt MutS2 das Ribosom in seine zwei Untereinheiten auf. So kann es für die spätere Herstellung anderer Proteine recycelt werden. Gleichzeitig wird das unfertige Protein über die sogenannte Ribosomen-assoziierte Proteinqualitätskontrolle dem Abbau zugeführt“, erläutert Dr. Pfeffer. Wie Prof. Joazeiro hervorhebt, ist der Mechanismus dieser Qualitätskontrolle vom Bakterium bis zum Menschen konserviert. „Ein besseres Verständnis dieses fundamentalen Prozesses in Bakterien könnte deshalb auch Aufschluss über Krankheitsmechanismen in Säugetieren geben, bei denen Defekte beim Abbau unfertiger Proteine mit Neurodegeneration und neuromuskulären Erkrankungen in Zusammenhang stehen“, so der Wissenschaftler.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
F. Cerullo, S. Filbeck, P. R. Patil, H.-C. Hung, H. Xu, J. Vornberger, F. W. Hofer, J. Schmitt, G. Kramer, B. Bukau, K. Hofmann, S. Pfeffer, C. A. P. Joazeiro; "Bacterial ribosome collision sensing by a MutS DNA repair ATPase paralogue"; Nature; 9 March 2022
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte

Neue Bilder führen zu einer besseren Vorhersage der Scherverdickung - Sie ist für alle Bereiche relevant, von der Öl- und Gasindustrie über die Pharmaproduktion und die Lebensmittelverarbeitung bis hin zur chemischen Industrie
Möglicher Therapieansatz gegen unheilbaren Blutkrebs - TUM-Forschende entdecken neuen Zell-Mechanismus beim Multiplen Myelom

Adipositas: Gefährliche Immunantwort - Falsche Ernährung führt zu fataler Aktivierung von Immunzellen: Neue molekulare Zusammenhänge entschlüsselt

Selbstheilender Kunststoff wird biologisch abbaubar - Mehr Umweltverträglichkeit durch neuen Grundbaustein, der mit Hilfe von Mikroorganismen hergestellt werden kann und vollständig biologisch abbaubar ist
Pregnandiol
Betanin
CD8-Rezeptor





















































