Neu entdeckter Proteinschalter reguliert Proteine in allen Lebensformen
Göttinger identifizieren neue Proteingruppen
Proteine bilden die chemische Grundlage des Lebens. Diese kleinen Maschinen werden benötigt, um Nahrung in Energie umzuwandeln, um Bewegung und Gehirnaktivitäten zu steuern und um Bakterien und Viren abzuwehren. Die Funktion der Proteine wird streng kontrolliert, wenn sich die Bedingungen ändern – wenn also ein Organismus unter Stress gerät und sich anpassen muss. Forscherinnen und Forscher der Universität Göttingen haben kürzlich eine neuartige Gruppe von Proteinen entdeckt, die als Schalter für die Steuerung biologischer Aktivitäten fungiert.
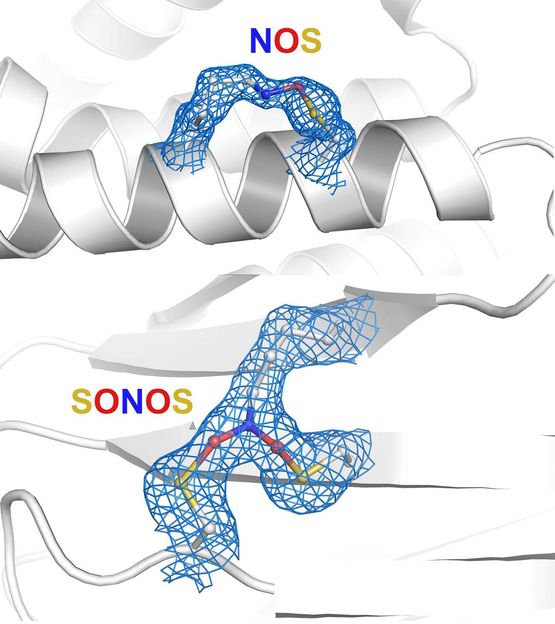
Das Forschungsteam entdeckte verschiedene Arten von Proteinschaltern, die inzwischen in allen Bereichen des Lebens eine wichtige Rolle spielen – von Viren wie dem Coronavirus bis hin zu Bakterien, Pilzen, Pflanzen und Tieren, einschließlich des Menschen. NOS-Gruppe (Stickstoff-Sauerstoff-Schwefel) oben und SONOS-Gruppe (Schwefel-Sauerstoff-Stickstoff-Sauerstoff-Schwefel) unten.
University of Göttingen
Sie haben nun alle bekannten Proteinstrukturen analysiert und festgestellt, dass diese Gruppe in allen Bereichen des Lebens vorkommt, in Viren und Bakterien ebenso wie in Pilzen, Pflanzen und Tieren, einschließlich des Menschen. Diese Erkenntnisse haben weitreichende Auswirkungen auf die Behandlung vieler Krankheiten. Die Ergebnisse sind in der Fachzeitschrift Nature Chemical Biology veröffentlicht.
Das Team der Universität Göttingen entdeckte den neuen Proteinschalter zunächst in einem Protein des menschlichen Bakteriums Neisseria gonorrhoeae. Dieser Schalter wird als „NOS-Schalter“ bezeichnet, weil Stickstoff-, Sauerstoff- und Schwefelatome miteinander verbunden sind. Allerdings blieb die Frage offen, ob dieser Schalter in der Natur weitverbreitet ist. Das Team hat nun die gesamte Datenbank bekannter Proteinstrukturen, die in einem öffentlich zugänglichen Archiv gespeichert ist, auf bisher unentdeckte NOS-Schalter hin untersucht. Die computergestützte Analyse durch Erstautor Dr. Fabian Rabe von Pappenheim, Universität Göttingen, ergab Hunderte Treffer, die dann alle einzeln detailliert analysiert wurden. „Diese Strukturen zu untersuchen, war ein spannendes Unterfangen. Es war für uns wie eine Reise ins Unbekannte“, erinnert sich Prof. Dr. Kai Tittmann, Universität Göttingen, der die Studie leitete.
Der NOS-Schalter wurde in allen Bereichen des Lebens gefunden, und zwar häufig an Stellen von Proteinen, die für die biologische Funktion wesentlich sind. Bemerkenswerterweise verfügen zahlreiche Proteine einiger der gefährlichsten menschlichen Krankheitserreger über diesen Schalter, darunter ein Schlüsselenzym des SARS-CoV-2-Coronavirus. An diesem Enzym setzt ein kürzlich zugelassenes, antivirales Medikament an. Darüber hinaus entdeckten die Forscherinnen und Forscher mehrere neue chemische Formen des NOS-Schalters. Die identifizierten Proteine spielen eine zentrale Rolle bei fast allen Aspekten zellulärer Aktivitäten, sei es bei der Expression von Genen, der Signalübertragung in und zwischen Zellen oder dem Stoffwechsel.
„Wir glauben, dass die Entdeckung dieser neuen Proteinschalter ein Sprungbrett für die Entwicklung einer neuen Klasse von Medikamenten sein wird, die direkt auf diese Schalter abzielen“, sagt Tittmann. „Viele menschliche Proteine, von denen bekannt ist, dass sie bei schweren Krankheiten eine Rolle spielen, aber auch Proteine aus Bakterien und Viren werden von solchen Schaltern gesteuert. Der neu identifizierte Schalter spielt wahrscheinlich auch bei der Regulierung ihrer biologischen Funktion eine zentrale Rolle.“
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Antibody Stabilizer von CANDOR Bioscience
Protein- und Antikörperstabilisierung leicht gemacht
Langzeitlagerung ohne Einfrieren – Einfache Anwendung, zuverlässiger Schutz

DynaPro NanoStar II von Wyatt Technology
NanoStar II: DLS und SLS mit Touch-Bedienung
Größe, Partikelkonzentration und mehr für Proteine, Viren und andere Biomoleküle

Holen Sie sich die Life-Science-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.